مقدمه ای بر پيوند كووالانسي و نامگذاری ترکیبات مربوطه
پيوند كووالانسي پيوندي است كه از به اشتراك گذاشتن الكترونها بين اتم ها بوجود مي آيد. به عنوان مثال ماده HCl را در نظر بگيريد. در اين ماده ما پيوند كووالانسي بين اتمهاي H و Cl داريم كه به اشتراك گذاشتن يك الكترون از هريك از اتمهاي H و Cl با هم نتيجه شده است. در صورتيكه از مدارهاي دايروي شكل براي نمايش الكترونهاي اتمهاي H و Cl استفاده كنيم، تشكيل پيوند كووالانسي بين اتم H و اتم Cl به صورت زير مي تواند نمايش داده شود:
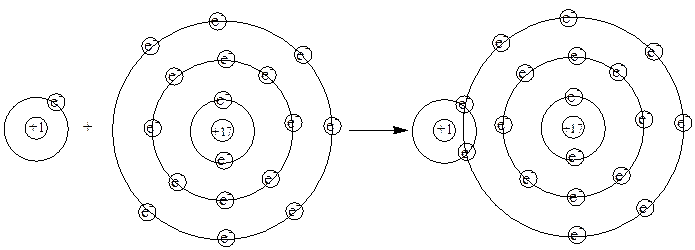
همانطور كه ديده مي شود، تنها الكترون اتم H با يكي از الكترونهاي لايه اصلي سوم اتم كلر بين اين دو اتم به اشتراك گذاشته مي شود. الكترونهاي به اشتراك گذاشته شده بين دو اتم، بين دو هسته قرار مي گيرند و جاذبه هر دو هسته را بطور همزمان احساس مي كنند، در حاليكه قبل از تشكيل پيوند كووالانسي تنها جاذبه هسته اتم خودشان را احساس مي كنند. در صورتيكه اين عامل مهمتر از دافعه ها ( همانطور كه در فصل بعدی به طور مفصل تري خواهيم ديد) باشد، نزديك شدن دو اتم به هم و به اشتراك گذاشتن الكترونها با هم و تشكيل پيوند كووالانسي همراه با افزايش جاذبه ها و كاهش سطح انرژي پتانسيل خواهد بود و بنابراين امري مطلوب خواهد بود.
انواع به اشتراك گذاشتن الكترونها را مي توان در نظر گرفت. ممكن است يك، دو، سه و ... بين دو، سه، چهار و ... اتم به صورت همزمان به اشتراك گذاشته شوند. ممكن است الكترونهاي به اشتراك گذاشته شده به صورت مساوي توسط اتمها تأمين شده باشند و از طرفي ديگر ممكن است به صورت نامساوي توسط اتمها تأمين شده باشند (مثلاً يكي از اتمها در مقايسه با اتم يا اتمهاي ديگر تعداد الكترونهاي بيشتري به اشتراك گذاشته باشد يا حتي كليه الكترونهاي به اشتراك گذاشته شده توسط تنها يك اتم تأمين شده باشد). به اشتراك گذاشتن تعداد زوج الكترون بين دو اتم از انواع ديگر به اشتراك گذاشتن الكترونها متداولتر است و معمولاً نصف الكترونهاي به اشتراك گذاشته شده توسط هر اتم تأمين مي شود.
مستقل از تعداد الكترونهاي به اشتراك گذاشته شده، تعداد هسته ها (اتمها)ي دخيل و نحوه به اشتراك گذاشته شدن الكترونها همگي در عمل به اشتراك گذاشتن الكترونها مشترك خواهند بود و از اين جهت ميتوانند پيوند كووالانسي در نظر گرفته شوند. همچنين رخ دادن (اتفاق افتادن) خودبخودي يا طبيعي هريك از انواع به اشتراك گذاشتن الكترونها را مي توان به قرارگيري الكترونها بين دو يا چند هسته و افزایش جاذبه ها به عنوان عامل تأثيرگذارتر و درنتيجه كاهش سطح انرژي پتانسيل و افزايش پايداري نسبت داد.
پيوند كووالانسي ممكن است بين اتهاي نافلزات با هم (مثلاً بين اتم كلر و اتم فلونور در مولكول ClF)، بين اتمهاي فلزات با هم (مثلاً بين دو اتم سدیم در مولكول Na2 که در فاز بخار قابل مشاهده است)،بين اتمهاي فلزات و نافلزات با هم (مثلاً بين اتم آهن با اتمهاي كربن در مولكول Fe(CO)5) مشاهده شود. اما اتمهاي فلزات و نافلزات معمولاً با هم پيوند يوني و اتمهاي فلزات معمولاً با هم پيوند فلزي مي دهند كه در ادامه با آنها آشنا خواهيم شد (پيوند يوني در ادامه همين فصل و به طور مفصل تر در كنار پيوند فلزي در فصل نيروهاي بين مولكولي و انواع جامدات معرفي خواهد شد). بنابراين پيوند كووالانسي معمولاً بين اتمهاي نافلزات با هم مشاهده مي شود. به عنوان مثال در مواد NH2OH, POCl3, CBr4, NF3, HCl و ... كه متشكل از نافلزات هستند، ما پيوند كووالانسي بين اتمهاي نافلزات داريم.
از يك
نگاه ديگر
پيوند
كووالانسي هم
در مواد متشكل
از مولكولهاي
مجزا از هم
(مثل SF4
, H2O و
...)، هم در مواد
متشكل از
يونهاي مجزا
از هم (مثل Na2SO4
كه متشكل از
يونهاي مجزا
از هم ![]() است
و در يونهاي
است
و در يونهاي ![]() بين
اتم S و اتمهاي O
پيوند
كووالانسي
داريم) و هم در
مواد متشكل از
اتمهاي
پيوسته به هم
با پيوند
كووالانسي به صورت
يكپارچه (مثل
الماس،
گرافيت و ...)
مشاهده مي شود
(با انواع
مواد بعداً به
طور مفصل تر
در فصل
نيروهاي بين مولكولي
و انواع
جامدات آشنا
مي شويم).
بين
اتم S و اتمهاي O
پيوند
كووالانسي
داريم) و هم در
مواد متشكل از
اتمهاي
پيوسته به هم
با پيوند
كووالانسي به صورت
يكپارچه (مثل
الماس،
گرافيت و ...)
مشاهده مي شود
(با انواع
مواد بعداً به
طور مفصل تر
در فصل
نيروهاي بين مولكولي
و انواع
جامدات آشنا
مي شويم).
نامگذاري تركيبات حاوي پيوند كووالانسي در حالت كلي مفصل بوده و از حوصله اين بحث و كتاب خارج است. در اينجا، ما فقط نامگذاري تركيبات محتوي فقط دو نافلز را كه تركيبات كووالانسي دوتايي (Binary Covalent Compounds) ناميده مي شوند، در نظر مي گيريم. براي نامگذاري اين تركيبات، نام نافلز با الكترونگاتيوتيه كمتر در ابتدا و نام نافلز با الكترونگاتيوتيه بيشتر بعلاوه يك پسوند «-يد»(-ide) در انتها ذكر مي شود. همچنين تعداد اتمهاي هر نافلز در فرمول تركيب با پيشوند مربوط به آن تعداد مشخص مي شود. پيشوندهاي مربوط به تعداد در جدول زير آمده است:
|
عدد |
پيشوند (Prefix) |
|
1 |
مونو(mono-) |
|
2 |
دي(di-) |
|
3 |
تري(tri-) |
|
4 |
تترا(tetra-) |
|
5 |
پنتا(penta-) |
|
6 |
هگزا(hexa-) |
|
7 |
هپتا(hepta-) |
|
8 |
اكتا(octa-) |
|
9 |
نونا(nona-) |
|
10 |
دكا(deca-) |
در صورتيكه از نافلز با الكترونگاتيوتيه كمتر تنها يك اتم داشته باشيم، پيشوند مونو به كار نمي رود. در صورتيكه از نافلز با الكترونگاتيوتيه بالاتر تنها يك اتم داشته باشيم، استفاده از پيشوند مونو دلخواه است. مثال در ادامه آمده را در نظر بگيريد.
مثال: نام تركيبات زير را بنويسيد:
![]()
حل:
با توجه به قواعد يادشده، نام تركيبات به صورت زير خواهد بود:
![]() :
كربن
تترابرميد،
:
كربن
تترابرميد، ![]() :
نيتروژن تري
فلوئوريد،
:
نيتروژن تري
فلوئوريد، ![]() :
گوگرد هگزا
فلوئوريد،
:
گوگرد هگزا
فلوئوريد،
![]() :
تترافسفر دكا
اكسيد،
:
تترافسفر دكا
اكسيد، ![]() :
آرسنیك پنتا
كلريد،
:
آرسنیك پنتا
كلريد، ![]() :
كربن
مونوكسيد،
:
كربن
مونوكسيد،
![]() :
دي نيتروژن
تري اكسيد،
:
دي نيتروژن
تري اكسيد، ![]() :
زنون اكتا فلوئوريد
:
زنون اكتا فلوئوريد
*****
واضح است كه با توجه به قواعد ياد شده، مي توان به آساني فرمول تركيب را از روی نامش مشخص کرد. مثال در ادامه آمده را در نظر بگيريد.
مثال: فرمول ترکیبات زیر را بر اساس نام نسبت داده شده بدست آورید.
ید تری فلوئورید، دی نیتروژن تترا اکسید، برم مونو کلرید
حل:
جوابها به ترتیب BrCl, N2O4, IF3 خواهند بود.
*****
در مورد برخی از این ترکیبات استفاده از نام معمول غیر علمی ترکیب رایج است و نام معمول غیر علمی ترکیب را بایستی به خاطر سپرد. بعبارتی نام مورد استفاده متداول برای این ترکیبات، نامی نیست که از قواعد نامگذاری یاد شده بدست می آید. مثالهایی از چنین ترکیباتی که در اغلب موارد ترکیبات هیدروژن دار نافلزات هستند، در جدول بعدی آمده است.
|
فرمول |
نام معمول |
|
H2O |
آب |
|
NH3 |
آمونیاک |
|
N2H4 |
هیدرازین |
|
BH3 |
بوران |
|
B2H6 |
دی بوران |
ترکیبات دوتايي هيدروژن و كربن که هيدروكربنها نامیده می شوند، روش نامگذاري مخصوص خود را دارند كه در شيمي آلي مطالعه مي شود. به عنوان مثال CH4 و C2H6 به ترتيب متان و اتان و .... و نه تتراهيدروژن كربيد و هگزا هيدروژن دي كربيد ناميده مي شوند.
مثال: نام ذکر شده برای کدام ترکیب غلط است؟
الف)N2F4: دی نیتروژن تترافلوئورید ب)C6O6:هگزا کربن هگزا اکسید ج)C2H4: تترا هیدروژن دی کربید د)IF: ید فلوئورید
حل:
گزینه (ج) صحیح است. C2H4 جز ترکیبات دوتايي هيدروژن و كربن (هيدروكربنها) است که روش نامگذاري مخصوص خود را دارند كه در شيمي آلي مطالعه مي شود. نام مابقی تركيبات كووالانسي دوتايي بدرستی ذکر شده است.
*****
تركيبات دوتايي هيدروژن با نافلزات كه در آب توليد كننده يون H+ هستند (مثل HCl كه در آب H+ و Cl- مي دهد) اسيد دوتايي محسوب مي شوند و روش نامگذاري اين اسيدها در آب به صورت زير است:
پيشوند «هيدرو» + ريشه نام غيرفلز+ پسوند «-يك» + كلمه «اسيد»
به عنوان مثال گاز HCl، گاز هيدروژن كلريد ناميده مي شود و هنگامي كه در آب حل مي شود، محلول هيدروكلريك اسيد توليد مي نمايد.
مثال: محلولی که از حل کردن هیدروژن یدید در آب بدست می آید را چه خواهید نامید؟
حل:
محلول هیدرویدیک اسید
*****
||||||||||||||||||||||||||||||||||||||||||||||||||
**************************************************
سایت: www.youngchemist.com
مولف: محمد شاهی
نظرات، پیشنهادات و انتقادات: chemistry.shahi@gmail.com
**************************************************
||||||||||||||||||||||||||||||||||||||||||||||||||