نیروهای بین مولکولی
به طور کلی بین اتم ها، یون ها و مولکول ها برهمکنشهای زیر متداول هستند:
پیوند کووالانسی، پیوند یونی، پیوند فلزی، پیوند یون ـ دوقطبی، پیوند دوقطبی ـ دوقطبی، پیوند یون ـ دوقطبی لحظه ای، پیوند دوقطبی ـ دوقطبی لحظه ای، پیوند لاندن و پیوند هیدروژنی.
با پیوندهای کووالانسی و یونی قبلا آشنا شده ایم. با پیوند فلزی در بخش جامدات فلزی آشنا خواهیم شد. در ادامه با مابقی پیوندهای یاد شده که در آنها معمولا مولکولها نیز دخیل هستند، آشنا می شویم.
پیوند یون ـ دوقطبی
پیوند یون ـ دوقطبی برهمکنشی است که بین یک یون و یک مولکول قطبی شکل می گیرد. قدرت برهمکنش یون ـ دوقطبی متناسب با بار یون و گشتاور دوقطبی مولکول قطبی است و با افزایش فاصله کاهش می یابد.
پیوند یون ـ دوقطبی می تواند مثلاً موقع انحلال جامدات یونی در حلالهای قطبی یا جامدات یونی حاوی مولکولهای قطبی مثل آب مشاهده شود. هنگامیکه یک یون در یک حلال قطبی حل می شود، یون با مولکولهای حلال، حلال پوشی می شود و تعدادی پیوند یون ـ دوقطبی تشکیل می شود.
تمرین: قدرت پیوندهای بین ذرات حل شونده و مولکولهای حلال با اندازه گیری گرمای مبادله شده در واکنش حلالپوشی که مربوط به حل شدن ذره در حلال است، مشخص می شود. در واکنش حلالپوشی ماده اولیه بایستی حتما گازی شکل باشد و واکنش حلالپوشی برای M که می تواند اتم، مولکول یا یون باشد، بصورت زیر نوشته می شود:
![]()
در واکنش بالا زیروند (sol) به معنای حلال پوشیده است. در صورتیکه حلال آب باشد، واکنش حلالپوشی واکنش آبپوشی نامیده می شود و بجای زیروند (sol) از زیروند (aq) استفاده می شود. بر این اساس به سوالات زیر پاسخ دهید:
الف) چرا گرمای
آزادشده در
واکنش آبپوشی ![]() (
(![]() )
بیشتر از
گرمای
آزادشده در
واکنش آبپوشی
)
بیشتر از
گرمای
آزادشده در
واکنش آبپوشی ![]() (
(![]() )
است؟
)
است؟
ب) چرا گرمای
آزادشده در
واکنش آبپوشی ![]() (
(![]() )
بیشتر از
گرمای
آزادشده در
واکنش آبپوشی
)
بیشتر از
گرمای
آزادشده در
واکنش آبپوشی ![]() (
(![]() )
است؟
)
است؟
ج) انتظار
دارید واکنش
آبپوشی ![]() در حلال آب
گرمازاتر
باشد یا در
حلال
آمونیاک؟
چرا؟
در حلال آب
گرمازاتر
باشد یا در
حلال
آمونیاک؟
چرا؟
*****
پیوند دوقطبی ـ دوقطبی
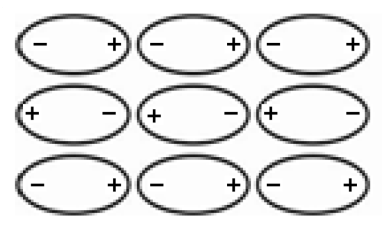
برهمکنش هایی هستند که بین مولکول های قطبی به وجود می آیند. قدرت پیوندهای قطبی ـ قطبی متناسب با حاصلضرب گشتاور دوقطبی مولکولهای قطبی برهمکنش کننده هستند و مشابه دیگر برهمکنش ها با افزایش فاصله ضعیفتر می شوند. شکل بعدی نمایشی از مولکولهای قطبی است که در کنار همدیگر قرار گرفته اند و با هم برهمکنشهای دو قطبی- دو قطبی دارند.
پیوند یون ـ دوقطبی لحظه ای
برهمکنشی است که بین یک یون و یک مولکول غیرقطبی شکل می گیرد. ابر الکترونی مولکول غیرقطبی در حالت عادی متقارن است. حضور یک یون یا مجاورت مولکول غیرقطبی با یون تقارن ابر الکتریکی مولکول غیرقطبی را به علت جاذبه و دافعه ابرالکتریکی مولکول غیرقطبی با یون بهم می زند. مثلاً اگر یون مثبت باشد، ابر الکترونی مولکول غیرقطبی به سمت یون مثبت کشیده می شود و در مجاورت یون مثبت فزونی ابر الکترونی یا بار جزئی منفی ایجاد می شود، درحالیکه در سمت دور از یون مثبت کمبود ابر الکترونی و بار جزئی مثبت ایجاد می شود. شکل زیر این مطلب را نمایش می دهد:

به علت پیدایش بارهای جزئی در مولکول غیرقطبی، بین یون و مولکول غیرقطبی جاذبه برقرار می شود. به بارهای جزئی حاصله روی مولکول غیرقطبی که تحت تأثیر عامل خارجی به وجود آمده اند، بارهای جزئی القایی گفته می شود و مولکول غیرقطبی را که به صورت لحظه ای بخاطر یک عامل خارجی به یک دوقطبی تبدیل شده است دوقطبی لحظه ای یا القائی می نامند.
مقدار بارهای جزئی القا شده بر روی مولکول غیرقطبی تابعی از بار یون و سهولت قطبیده شدن مولکول غیرقطبی است و با افزایش آنها افزایش می یابد. قطبش پذیری یا α بیانگرسهولت قطبیده شدن مولکول غیرقطبی است و به طور کلی با افزایش اندازه مولکول افزایش می یابد. با افزایش بارهای جزئی القا شده بر روی مولکول غیرقطبی و بار یون و کاهش فاصله مولکول غیرقطبی و یون، پیوند یون – دو قطبی لحظه ای قویتر می شود.
پیوند دوقطبی ـ دوقطبی لحظه ای
برهمکنشی است که بین یک مولکول قطبی و یک مولکول غیرقطبی ایجاد می شود. در صورت مجاورت یک مولکول قطبی و یک مولکول غیرقطبی، تحت تأثیر بارهای جزئی دائمی مولکول قطبی، در مولکول غیرقطبی بارهای جزئی القا می شوند، مولکول غیرقطبی به صورت یک دوقطبی لحظه ای در می آید و بین مولکول قطبی و مولکول غیرقطبی جاذبه برقرار می شود که به جاذبه حاصل پیوند دو قطبی دائمی - دوقطبی لحظه ای (القائی) یا دوقطبی - دوقطبی لحظه ای ( القائی) یا قطبی- قطبی لحظه ای (القائی) می گویند. شکل زیر این مطلب را نشان می دهد:

مقدار بارهای جزئی القایی و قدرت برهمکنش متناسب با گشتاور دوقطبی مولکول قطبی و قطبش پذیری مولکول غیرقطبی است. این برهمکنش مثلاً در انحلال مواد غیرقطبی در حلالهای قطبی یا بالعکس مشاهده می شود.
پیوند لاندن
برهمکنشی است که در کلیه مواد بین سایر برهمکنشهای ممکن وجود دارد. برای مواد غیرقطبی، این برهمکنش تنها برهمکنش ممکن بین مولکول های غیرقطبی است و برای مابقی مواد معمولا ضعیف تر و کم اهمیت تر از برهمکنش های دیگر است، بهمین جهت پیوند لاندن برای مواد غیرقطبی بیشترین اهمیت را دارد و معمولا تشکیل آن بین مولکول های غیرقطبی درنظر گرفته می شود و بررسی می شود. درصورتیکه به هر دلیلی تقارن ابر الکتریکی یک مولکول غیرقطبی بهم بخورد، مولکول غیرقطبی به یک دوقطبی لحظه ای تبدیل می شود و این دوقطبی لحظه ای، مولکولهای غیرقطبی اطراف را نیز به خاطر القا به دوقطبی لحظه ای تبدیل خواهد کرد و در نتیجه بین مولکول ها میتواند جاذبه برقرار شود. از جاذبه های حاصله بعنوان پیوند لاندن یاد می شود. شکل زیر این مطلب را نشان می دهد:

شکل: در حالت (a) مولکولهای غیرقطبی در کنار هم قرار دارند، در حالت (b)تقارن ابر الکتریکی یک مولکول غیرقطبی بهم خورده است و تبدیل به یک دوقطبی لحظه ای شده است، در حالت (c) دوقطبی لحظه ای حالت (b) مابقی مولکولهای غیرقطبی را نیز به دوقطبی های لحظه ای تبدیل کرده است و بین مولکولها جاذبه برقرار شده است.
دوقطبی های لحظه ای ایجاد شده به راحتی می توانند وارونه شوند و در نتیجه به طور میانگین گشتاور دوقطبی مولکول ها صفر است، اما جاذبه بین آنها به طور میانگین غیرصفر است و وجود دارد. قدرت این برهمکنشها بستگی شدیدی به قطبش پذیری مولکول دارد و با افزایش اندازه مولکول به سرعت رشد می کند.
نیروهای لاندن به طور کلی تابعی از اندازه مولکول و شکل مولکول هستند که اندازه مولکول مهمترین فاکتور محسوب می شود.
هر چه اندازه مولکول بزرگتر باشد (تعداد اتمهای بیشتری داشته باشد و از اتمهای بزرگتری تشکیل شده باشد)، ابر الکترونی آن نیز بزرگتر خواهد بود که قطبش پذیری بیشتری برای مولکول نتیجه خواهد داد و احتمال تشکیل دوقطبی های لحظه ای و گشتاور دو قطبی بالاتر برای دوقطبی های لحظه ای تشکیل شده بیشتر خواهد شد و بنابراین نیروهای لاندن و نیروهای بین مولکولی قویتر خواهند بود. این مطلب می تواند خودش را به صورت افزایش دمای ذوب و جوش ترکیبات با افزایش اندازه آنها نشان دهد.
مثال: چرا فلوئور و کلر در دمای اتاق گاز هستند، درحالیکه برم مایع و ید جامد هستند؟
حل:
هالوژنها به صورت مواد متشکل از مولکولهای دواتمی غیرقطبی مجزا از هم هستند که تنها برهمکنش ممکن بین مولکولهای آنها برهمکنش لاندن است. قدرت این برهمکنش در گروه هالوژنها از فلوئور تا ید بعلت افزایش اندازه افزایش می یابد که منجر به افزایش دمای ذوب و جوش در گروه هالوژنها از بالا به پایین می شود.
*****
مثال: چرا دمای ذوب و جوش گازهای نجیب از هالوژنهای همدوره کمتر است؟
حل:
گازهای نجیب تک اتمی هستند، در حالیکه هالوژنها از مولکولهای دو اتمی تشکیل شده اند. بنابراین مولکولهای هالوژنها از نظر اندازه بایستی تقریبا دو برابر اتمهای گازهای نجیب باشند و در نتیجه لاندن قویتری داشته باشند. لاندن قویتر هالوژنها دمای ذوب و جوش بیشتری برای آنها در مقایسه با گازهای نجیب همدوره نتیجه می دهد.
*****
تمرین:دمای ذوب و جوش بالاتری برای فسفر سفید( P4 ) یا گوگرد اورتورومبیک ( S8 ) انتظار می رود؟ چرا؟
*****
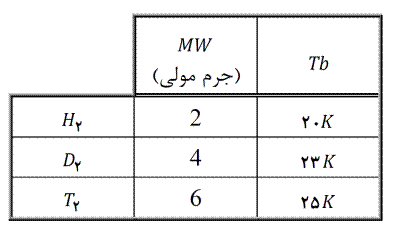
با توجه به اینکه معمولاً با افزایش جرم مولکول، اندازه مولکول نیز زیاد می شود، گاهی اوقات می گویند نیروهای لاندن با جرم مولکولها متناسب اند، اما در صورتیکه افزایش جرم مولکولها منجر به افزایش اندازه مولکولها نشود (مثل مورد ایزوتوپ ها) متناسب بودن نیروهای لاندن با جرم مولکولها صادق نخواهد بود. بعنوان مثال می توان دمای جوش ایزوتوپ های هیدروژن (که تنها پیوند لاندن بین مولکولهای آنها وجود دارد) را درنظر گرفت. با وجوداینکه از هیدروژن به تریتیم جرم سه برابر می شود، اما اندازه و در نتیجه نیروهای بین مولکولی و دمای جوش چندان تغییر نمی یابد:
شکل
مولکولها نیز
در تعیین قدرت
پیوند لاندن
تاثیرگذار است.
نیروهای
لاندن برای
تشکیل
نیازمند تماس
مولکولها با
یکدیگرند. هر
چه سطح تماس
مولکولها با
هم بیشتر
باشد،
نیروهای
لاندن نیز
قویتر خواهند
بود. شکلهای
مسطح به
مولکولها
اجازه می دهند
که سطح تماس
خوبی داشته
باشند و در
نتیجه لاندن
خوبی برقرار
کنند. شکلهای
کروی سطح تماس
کمی دارند و
منجر به
نیروهای
لاندن ضعیفتر
می شوند. به
عنوان مثال ![]() و
و
![]() هر
دو غیرقطبی
هستند و
هر
دو غیرقطبی
هستند و ![]() بزرگتر
از
بزرگتر
از ![]() است.
با این وجود
به دلیل شکل
مسطح
است.
با این وجود
به دلیل شکل
مسطح ![]() در
مقایسه با شکل
کروی
در
مقایسه با شکل
کروی ![]() دمای
جوش
دمای
جوش ![]() بیشتر
از
بیشتر
از ![]() است.
به عنوان مثال
دیگر دمای جوش
CH3CH2CH2CH2CH3 با شکل
استوانه ای
مانند از دمای
جوش C(CH3)4 با شکل
کروی مانند با
وجود ایزومر و
هم اندازه
بودن بیشتر
است.
است.
به عنوان مثال
دیگر دمای جوش
CH3CH2CH2CH2CH3 با شکل
استوانه ای
مانند از دمای
جوش C(CH3)4 با شکل
کروی مانند با
وجود ایزومر و
هم اندازه
بودن بیشتر
است.
پیوند هیدروژنی
پیوندی
است که بین یک
اتم هیدروژن
با بار جزئی
مثبت بزرگ (بعلت
اتصال به اتمهای
الکترونگاتیوی
مثل ![]() و
و
![]() یا
اتصال به گروه
های
الکترونگاتیوی
مثل –CF3 و –CCl3 ) و یک اتم
کوچک حاوی جفت
الکترون
غیرپیوندی با
بار جزئی منفی
بزرگ (
یا
اتصال به گروه
های
الکترونگاتیوی
مثل –CF3 و –CCl3 ) و یک اتم
کوچک حاوی جفت
الکترون
غیرپیوندی با
بار جزئی منفی
بزرگ (![]() و
و ![]() ) تشکیل می شود.
معمولا پیوند
هیدروژنی را
با نقطه چین
بین اتم
هیدروژن و اتم
دیگر تشکیل
دهنده پیوند
هیدروژنی
نمایش می
دهیم. بعنوان
مثال در مواد HF ، H2O
و NH3 پیوند
هیدروژنی بین
مولکولها
داریم:
) تشکیل می شود.
معمولا پیوند
هیدروژنی را
با نقطه چین
بین اتم
هیدروژن و اتم
دیگر تشکیل
دهنده پیوند
هیدروژنی
نمایش می
دهیم. بعنوان
مثال در مواد HF ، H2O
و NH3 پیوند
هیدروژنی بین
مولکولها
داریم:

معمولا با افزایش بار جزئی مثبت روی هیدروژن و بار جزئی منفی روی اتم دیگر پیوند هیدروژنی قویتر می شود. بعنوان مثال داریم:

بنابراین
جای تعجبی
نخواهد داشت
درصورتیکه یکی
از قویترین
پیوندهای
هیدروژنی را
در ترکیب یون F- با مولکول HF یعنی یون ![]() مشاهده
کنیم که انرژی
پیوند آن در
حد یک پیوند
کووالانسی ضعیف
مثل I-I
است:
مشاهده
کنیم که انرژی
پیوند آن در
حد یک پیوند
کووالانسی ضعیف
مثل I-I
است:
![]()
تمرین: ترتیب قدرت پیوند هیدروژنی نمایش داده شده در شکل زیر را چگونه توجیه می کنید؟
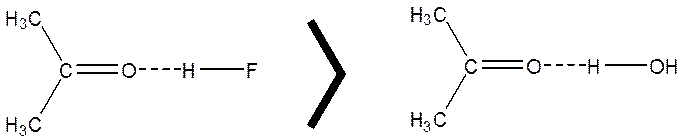
*****
پیوند هیدروژنی ضعیفتر از پیوند یونی و کووالانسی اما معمولا قویتر از دیگر پیوندها مثل قطبی و لاندن است. بنابراین ترکیبات با قابلیت تشکیل پیوند هیدروژنی از ترکیبات قطبی و غیرقطبی بدون این قابلیت معمولاً دمای ذوب و جوش بیشتری دارند. بعنوان مثال در حالیکه در ترکیبات دو تایی عناصر گروه چهار اصلی با هیدروژن یعنی CH4, SiH4, GeH4, SnH4, PbH4، از CH4 به PbH4 بعلت افزایش اندازه و قدرت نیروهای بین مولکولی لاندن دمای جوش افزایش می یابد، در ترکیبات دو تایی عناصر گروه پنجم اصلی با هیدروژن یعنیNH3, PH3, AsH3, SbH3 از PH3 به SbH3 دمای جوش بعلت افزایش اندازه و قدرت نیروهای بین مولکولی لاندن افزایش می یابد، اما دمای جوش NH3 که می تواند پیوند هیدروژنی بدهد از PH3 با وجود آنکه اندازه بزرگتری دارد اما پیوند هیدروژنی ندارد بیشتر است. روند مشابهی برای دمای جوش ترکیبات دو تایی عناصر گروه ششم و هفتم اصلی با هیدروژن مشاهده می شود.
زاویه
ایده آل برای
پیوند
هیدروژنی و
پیوند
کووالانسی حول
اتم هیدروژن
برابر ![]() است
( دقت داشته
باشید که در
اینجا حول اتم
هیدروژن می
توانیم آرایش AB2 در نظر
بگیریم). بهمین
جهت مواد حاوی
پیوند
هیدروژنی
ساختارهایی
با ویژگیهای
بخصوصی اتخاذ
می کنند که این
زاویه را داشته
باشند. در
ادامه چند
مثال را برای
این موضوع
درنظر می
گیریم.
است
( دقت داشته
باشید که در
اینجا حول اتم
هیدروژن می
توانیم آرایش AB2 در نظر
بگیریم). بهمین
جهت مواد حاوی
پیوند
هیدروژنی
ساختارهایی
با ویژگیهای
بخصوصی اتخاذ
می کنند که این
زاویه را داشته
باشند. در
ادامه چند
مثال را برای
این موضوع
درنظر می
گیریم.
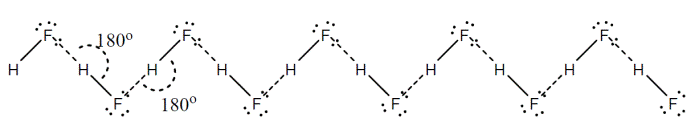
مولکولهای
![]() در
حالت مایع به
صورت زیر زیگزاگی
شکل هستند:
در
حالت مایع به
صورت زیر زیگزاگی
شکل هستند:
مولکولهای
![]() و
و
![]() در
حالت بخار به
صورت زیر هستند:
در
حالت بخار به
صورت زیر هستند:

در یخ هر
مولکول آب با
چهار مولکول
آب دیگر پیوند
هیدروژنی می دهد
و به منظور
ایجاد زاویهی
ایدهآل ![]() یخ
مجبور است
ساختاری
پرحفره یا باز
داشته باشد. این
مطلب را در
شکل بعدی که
نمایشی از
ساختار یخ
است، می توان
تحقیق نمود:
یخ
مجبور است
ساختاری
پرحفره یا باز
داشته باشد. این
مطلب را در
شکل بعدی که
نمایشی از
ساختار یخ
است، می توان
تحقیق نمود:
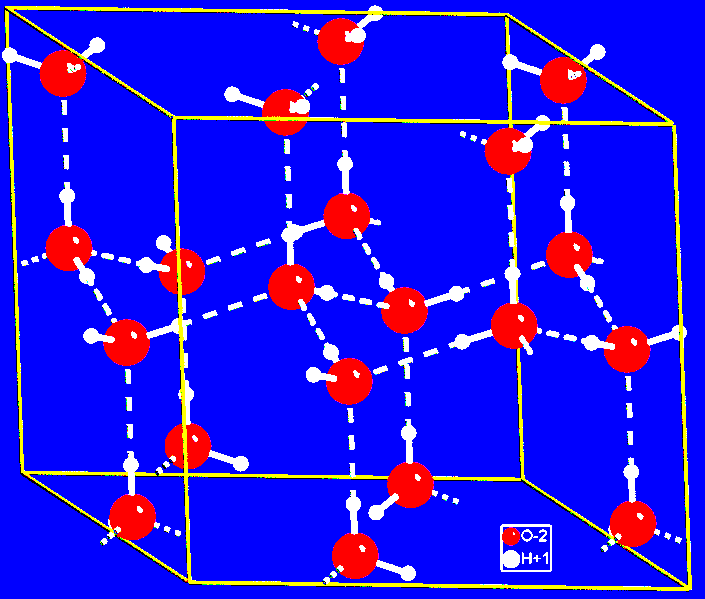
هنگامیکه
یخ آب می شود
برخی از
پیوندهای
هیدروژنی
شکسته می شوند
و حفره های
ساختار باز
شروع به پر
شدن می کنند.
به همین جهت
چگالی آب از
یخ بیشتر است.
برای آب از
صفر درجه
سانتیگراد تا
حدود 4 درجه
سانتیگراد با
افزایش دما
پیوندهای هیدروژنی
بیشتری می شکنند
و حفره ها
بیشتر پر می شوند.
در نتیجه
چگالی آب از
صفر درجه سانتیگراد
تا حدود 4
درجه
سانتیگراد
افزایش می یابد.
از ![]() به
بالا با
افزایش دما به
علت افزایش
جنب و جوش های
مولکولی و
دورتر شدن
مولکول ها از
هم حجم زیادتر
می شود و
چگالی کاهش می
یابد. روند
تغییرات
چگالی آب بر
حسب دما به
صورت نمودار
بعد است:
به
بالا با
افزایش دما به
علت افزایش
جنب و جوش های
مولکولی و
دورتر شدن
مولکول ها از
هم حجم زیادتر
می شود و
چگالی کاهش می
یابد. روند
تغییرات
چگالی آب بر
حسب دما به
صورت نمودار
بعد است:
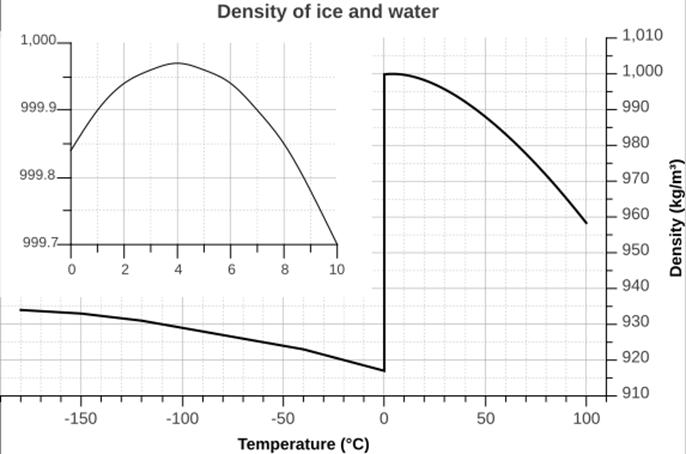
در تعیین دمای جوش هم قدرت پیوند هیدروژنی و هم تعداد پیوند هیدروژنی حائز اهمیت است. بعنوان مثال برای مواد HF ، H2O و NH3 داریم:
![]() :ماکزیمم
میانگین
تعداد پیوند
هیدروژنی برای
هر مولکول
:ماکزیمم
میانگین
تعداد پیوند
هیدروژنی برای
هر مولکول
از طرفی ترتیب قدرت پیوند هیدروژنی برای مواد HF ، H2O و NH3 به صورت زیر است:
![]() :قدرت
پیوند
هیدروژنی
:قدرت
پیوند
هیدروژنی
ترکیب تعداد و قدرت پیوند هیدروژنی، ترتیب دمای جوش زیر را برای مواد HF ، H2O و NH3 نتیجه می دهد:
![]() :دمای
جوش
:دمای
جوش
همانطور که دیده می شود، با وجود قویتر بودن پیوند هیدروژنی در HF دمای جوش H2O بعلت تعداد پیوند بیشتر بالاتر است.
تمرین: دماهای جوش اتیلن گلیکول (CH2OHCH2OH)، گلیسرول (CH2OHCHOHCH2OH) و هیدرازین (N2H4) به ترتیب برابر 197.3، 290 و 114 درجه سانتیگراد هستند. چگونه توجیه می کنید؟
***
مقایسه قدرت پیوندها
مقایسه قدرت پیوندهای مختلف در مقایسه خواص مواد مختلف حاوی این پیوندها مفید واقع می شود. بطور کلی پیوندهای یونی، کووالانسی و فلزی قویتر از دیگر پیوندها هستند. برای مابقی پیوندها معمولا ترتیب زیر از نظر قدرت و انرژی پیوند برقرار است:
![]() قطبی- قطبی
قطبی- قطبی![]() هیدروژنی
هیدروژنی![]() لاندن
مولکول های
بزرگ
لاندن
مولکول های
بزرگ ![]() یون- قطبی
یون- قطبی
لاندن مولکول
های کوچک ![]() قطبی- قطبی
لحظه ای
قطبی- قطبی
لحظه ای![]() یون- قطبی
لحظه ای
یون- قطبی
لحظه ای
مثال: ترکیبات زیر را از نظر دمای جوش با هم مقایسه کنید و برای مقایسه خود دلیل بیاورید.
KBr, CH4, MgO, H2O, H2
حل:
مواد MgO و KBr یونی هستند و از آنجاییکه پیوند یونی جز قویترین هاست، دمای جوش بالایی برای آنها انتظار می رود. یونهای سازنده MgO در مقایسه با یونهای سازنده KBr بار بیشتر و اندازه کوچکتری دارند، در نتیجه جاذبه یونها و بالطبع دمای جوش در MgO بایستی بیشتر از KBr باشد. مولکولهای H2O می توانند پیوند هیدروژنی تشکیل دهند در نتیجه دمای جوش آن بایستی بیشتر از CH4 و H2 باشد که از مولکولهای کوچک غیرقطبی تشکیل شده اند و تنها برهم کنشهای ضعیف لاندن دارند. بین CH4 و H2 ، CH4 اندازه بزرگتر و در نتیجه لاندن قویتر و دمای جوش بالاتری دارد. بنابراین مقایسه دمای جوش مواد یاد شده به صورت زیر خواهد بود:
MgO> KBr> H2O> CH4> H2
*****
||||||||||||||||||||||||||||||||||||||||||||||||||
**************************************************
سایت: www.youngchemist.com
مولف: محمد شاهی
نظرات، پیشنهادات و انتقادات: chemistry.shahi@gmail.com
**************************************************
||||||||||||||||||||||||||||||||||||||||||||||||||