شعاع های اتمی و یونی
شعاع
های اتمی و
یونی برای
مشخص شناختن
حد و مرز اتم
ها و یون ها به
كار می روند.
با توجه به مدل
اوربیتال
اتمی برای یك
اتم یا یون
جدا و تنها
نمی توان حد و
مرز قائل شد،
اما در ساختار
بلوری مواد
جامد كه اتم
ها و یون ها در
كنار هم قرار
می گیرند می
توان حد و مرز آنها
را مشخص كرد و با
فرض آنها
بصورت کره های
صلب به آنها
شعاع های یونی ( Ionic
Radius که می
تواند با ri نشان داده
شود)،
کووالانسی ( Covalent
Radius که می
تواند با rc نشان داده
شود) و
واندروالسی ( Van der
waals Radius که
می تواند با rv نشان داده
شود) نسبت داد. بطور
خلاصه و ساده
فاصله مراکز
هسته های دو
یون مماس بر
هم برابر
مجموع
شعاعهای یونی
آن دو یون،
فاصله مراکز
هسته های دو
اتم تشکیل
دهنده پیوند
کووالانسی با
هم برابر
مجموع
شعاعهای
کووالانسی آن
دو اتم و
فاصله مراکز
هسته های دو
اتم مماس بر
هم برابر
مجموع
شعاعهای
واندروالسی
آن دو اتم در
نظر گرفته می
شود. بعنوان
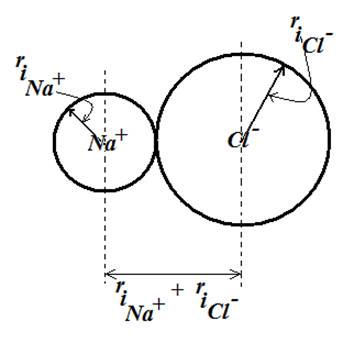
مثال برای
شعاع یونی،
فاصله یونهای
سدیم و کلرید
مماس بر هم در
بلور سدیم
کلرید می تواند
برابر مجموع شعاعهای
یونی یونهای
سدیم وکلرید (![]() )
در نظر گرفته
شود. شکل بعدی
را در نظر
بگیرید:
)
در نظر گرفته
شود. شکل بعدی
را در نظر
بگیرید:
بعنوان
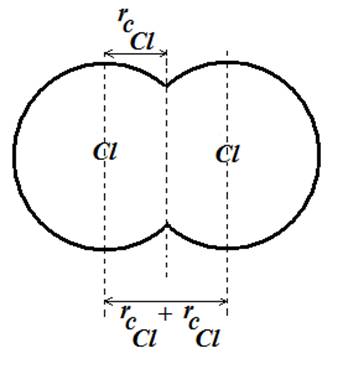
مثال برای
شعاع
کووالانسی،
فاصله اتمهای
کلر در مولکول
کلر می تواند
برابر مجموع شعاعهای
کووالانسی دو
اتم کلر (![]() )
در نظر گرفته
شود. شکل بعدی
را در نظر بگیرید:
)
در نظر گرفته
شود. شکل بعدی
را در نظر بگیرید:
بعنوان
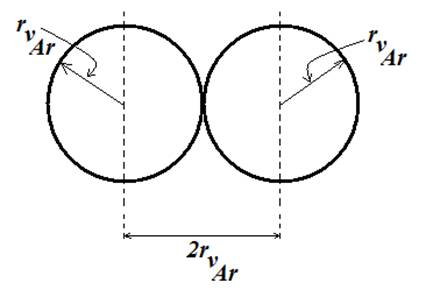
مثال برای
شعاع
واندروالسی،
فاصله اتمهای
آرگون در بلور
آرگون می
تواند برابر
مجموع شعاعهای
واندروالسی
دو اتم آرگون (![]() )
در نظر گرفته
شود. شکل بعدی
را در نظر
بگیرید:
)
در نظر گرفته
شود. شکل بعدی
را در نظر
بگیرید:
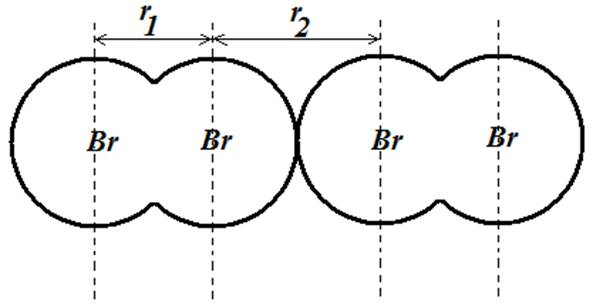
تمرین: دو مولکول برم مماس بر هم در شکل زیر نمایش داده شده اند. شعاع های کووالانسی و واندروالسی اتم برم را در شکل زیر مشخص نمائید و ارتباط فواصل r1 و r2 با آنها را بنویسید.
*****
برای فلزات علاوه بر شعاع های یونی، کووالانسی و واندروالسی می توان شعاع فلزی نیز در نظر گرفت. نزدیکترین فاصله مراکز هسته های دو اتم فلز مشارکت کننده در پیوند فلزی در بلور فلز برابر مجموع شعاعهای فلزی آن دو اتم در نظر گرفته می شود.
گاهی اوقات از اصطلاح شعاع اتمی استفاده می شود که ابهام دارد و در منابع مختلف گاهی بجای شعاع های کووالانسی، گاهی بجای شعاع های واندروالسی و گاهی بجای شعاع های فلزی اما نه یونی بکار رفته است. در اینجا هر وقت صحبت از شعاع اتمی است، بدین معنی است که مطلب ارائه شده برای هر سه نوع شعاع یعنی کووالانسی، واندروالسی و فلزی صادق است.
در یك گروه از جدول تناوبی معمولا شعاع اتم ها از بالا به پایین بعلت افزایش تعداد لایه ها، افزایش می یابد. بعنوان مثال شعاع واندروالسی اتمهای فلزات قلیائی خاکی یعنی Ba, Sr,Ca, Mg, Be و Ra به ترتیب برابر 268, 249, 231, 173, 153 و 283 پیکومتر هستند که از بریلیم به باریم یا از بالا به پایین در گروه افزایش نشان می دهد. گاهی اوقات از بالا به پایین در برخی گروه ها افزایش قابل توجه نداریم یا حتی کاهش داریم که در بحث اثر d و f در بخش بعدی بدان خواهیم پرداخت.
در یك دوره از جدول تناوبی شعاع اتمی از چپ به راست بعلت افزایش بار مؤثر هسته كاهش می یابد. بعنوان مثال شعاع کووالانسی اتمهای عناصر تناوب سوم جدول تناوبی یعنی Cl, S, P, Si, Al, Mg, Na و Ar را می توان در نظر گرفت که بترتیب برابر 0.99, 1.02, 1.06, 1.11, 1.18, 1.30, 1.54 و 0.97 آنگستروم هستند که از سدیم به آرگون یا از چپ به راست در دوره کاهش نشان می دهد. گاهی اوقات از چپ به راست در برخی دوره ها بجای کاهش شعاع افزایش داریم که دلایل مختص خودشان را دارند. بعنوان مثال شعاع فلزی در اواخر سری عناصر واسطه ( از گروه VIIIB به گروه IIB ) از چپ به راست بجای کاهش افزایش می یابد که می تواند به کاهش قدرت پیوند فلزی، ضعیف تر شدن جاذبه ها برای غلبه بر دافعه ها و کمتر نزدیک شدن اتمها بهم نسبت داده شود.
با كندن الكترون و حذف دافعه های بین الكترونی بار مؤثر هسته و قدرت كنترل هسته بر روی الكترون ها افزایش می یابد و در نتیجه شعاع كاهش می یابد. بطور بالعكس با افزودن الكترون شعاع افزایش می یابد. بعنوان مثال داریم:
![]()
برای یون های هم الكترون ( ایزوالكترون) با افزایش تعداد پروتون های هسته، جاذبه هسته با الکترونها افزایش می یابد و شعاع کم می شود. بعنوان مثال داریم:
با توجه به نکات بالا می توان دید که در مقایسه شعاع یونها در حالت کلی بایستی هم به تعداد لایه ها و هم به بار یون توجه نمود. همانطور که بحث کردیم تعداد لایه های کمتر و بار مثبت تر منجر به شعاع کمتر برای یون می شود و بالعکس. بعنوان مثال شعاع یونی Rb+, O2- و Sr2+ بترتیب 152,140 و 118 پیکومتر است. کمتر بودن شعاع یونی O2- از Rb+ می تواند به اهمیت بیشتر کم بودن تعداد لایه ها در O2- نسبت داده شود، در حالیکه بیشتر بودن شعاع یونی O2- از Sr2+ می تواند به اهمیت بیشتر مثبت تر بودن Sr2+ و بار موثر هسته بیشترش نسبت داده شود.
در یونها، افزایش بار یون ( چه مثبت و چه منفی) منجر به افزایش جاذبه یونها با هم و در نتیجه نزدیکتر شدن آنها بهم و کاهش شعاع یونها می شود. این مطلب افزایش شعاع آنیون بعلت منفی تر شدن را تعدیل (کم) می کند، در حالیکه کاهش شعاع کاتیون بعلت مثبت تر شدن را تشدید (زیاد) می کند. از این رو است که افزایش شعاع آنیون بعلت منفی تر شدن بطور قابل ملاحظه ای کمتر از کاهش شعاع کاتیون بعلت مثبت تر شدن است. بعنوان مثال از S2- به Cl- شعاع یونی 1.6% کاهش می یابد، در حالیکه از K+ به Ca2+ شعاع یونی 25.6% کاهش می یابد. باز از این رو است که یونهای دو منفی کالکوژنها از یونهای یک منفی هالوژنهای همدوره به مقدار خیلی جزئی بزرگترند و می توانند تقریبا هم اندازه محسوب شوند.
از آنجائیکه از بالا به پایین در گروهها بار موثر هسته افزیش می یابد، اهمیت افزایش بار موثر هسته با مثبت تر شدن یون بصورت نسبی کاهش می یابد و تغییرات شعاع یونها بعلت تغییرات بار یون هم بصورت نسبی و درصدی کاهش می یابد. بعنوان مثال شعاع یونی از Li+ به Be2+ که در بالای گروههایشان هستند، 54% کاهش نشان می دهد، در حالیکه از Cs+ به Ba2+ که در پایین گروههایشان هستند، 19.2% کاهش نشان می دهد. بعنوان مثال دیگر شعاع یونی از O2- به F- که در بالای گروههایشان هستند، 5% کاهش نشان می دهد، در حالیکه از Te2- به I- که در پایین گروههایشان هستند، 0.4% کاهش نشان می دهد.
مثال : كدام گزینه براساس افزایش شعاع از چپ به راست مرتب شده است ؟
الف
) Na
, Mg , Al , Si ب
) ![]()
حل:
در گزینه (الف) از چپ به راست یعنی از سدیم به سیلیسیم حرکت در دوره سوم از چپ به راست را داریم که بعلت افزایش بار موثر هسته بایستی کاهش شعاع داشته باشیم. در گزینه (ب) از چپ به راست یعنی از O2- به O+ کاهش تعداد الکترونها و افزایش بار موثر هسته را داریم، پس بایستی کاهش شعاع داشته باشیم. در گزینه (ج) از چپ به راست یعنی از Li+ به Cs+ حرکت در گروه فلزات قلیائی از بالا به پائین را داریم که بعلت افزایش تعداد لایه ها بایستی افزایش شعاع داشته باشیم. در گزینه (د) از چپ به راست یعنی از S2- به K+ افزایش عدد اتمی در یونهای هم الکترون را داریم، پس بایستی کاهش شعاع داشته باشیم. بنابراین گزینه (ج) پاسخ صحیح است.
*****
مثال : انتظار دارید بین تفاوت شعاع Na و Na+ و تفاوت شعاع Mg و Mg+ کدامیک بیشتر باشد؟ چرا؟
حل:
تفاوت شعاع Na و Na+ ، چونکه موقع یونش اتم سدیم یک لایه اصلی از بین می رود، اما موقع یونش اول اتم منیزیم تغییر تعداد لایه اصلی نداریم.
*****
مثال
: فاصله بین ![]() و
و
![]() به
صورت مماس
برهم در جامد
یونی NaF
برابر 231 pm
در نظر گرفته شود.
قاعده ای بیان
می كند كه
برای یون های
هم الكترون
نسبت شعاع های
یونی برابر
عكس نسبت بار
مؤثر هسته های
آنهاست. اگر
بار مؤثر هسته
ی یون
فلوئورید
تقریباً 5
در نظر گرفته
شود، شعاع یون
های
به
صورت مماس
برهم در جامد
یونی NaF
برابر 231 pm
در نظر گرفته شود.
قاعده ای بیان
می كند كه
برای یون های
هم الكترون
نسبت شعاع های
یونی برابر
عكس نسبت بار
مؤثر هسته های
آنهاست. اگر
بار مؤثر هسته
ی یون
فلوئورید
تقریباً 5
در نظر گرفته
شود، شعاع یون
های ![]() و
و
![]() را
بدست آورید.
را
بدست آورید.
حل:
دو معادله و دو مجهول بصورت زیر می توانیم تشکیل دهیم:
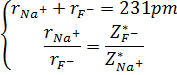
در
روابط بالا به
Z* یون سدیم
نیاز داریم.
برای تعیین آن
بدین صورت می
توانیم عمل
کنیم که
یونهای سدیم و
فلوئورید هم
الکترون
هستند، پس
تعداد
الکترونها، آرایش
الکترونی و
نحوه قرار
گرفتن
الکترونها نسبت
بهم در آنها
یکسان است و
بنابراین
بایستی اثر
پوششی
الکترونها
روی هم (S)
در آنها یکسان
باشد. در
اینصورت با
استفاده از
رابطه Z*=Z-S می توان
نتیجه گیری
کرد که چون
عدد اتمی یون
سدیم دو واحد
از عدد اتمی
یون فلوئورید
بیشتر است،
بار موثر هسته
آن هم دو واحد
بیشتر از یون فلوئورید
است و برابر 7
است. سپس با
جایگذاری Z* یون سدیم
در دو معادله و
دو مجهول بالا
می توانیم شعاع
یون های ![]() و
و
![]() را
بصورت زیر
بدست آوریم:
را
بصورت زیر
بدست آوریم:
![]()
*****
مثال : اتم هیدروژن از اتم فلوئور کوچکتر است، اما یون هیدرید (H-) از یون فلوئورید (F-) بزرگتر است. چگونه توجیه می كنید؟
حل:
کوچکتر بودن اتم هیدروژن از اتم فلوئور می تواند به تعداد لایه های الکترونی کمتر آن نسبت داده شود که با وجود بار موثر هسته بیشتر در اتم فلوئور منجر به شعاع کمتر اتم هیدروژن در مقایسه با اتم فلوئور می شود. از اتم هیدروژن به یون هیدرید یا از اتم فلوئور به یون فلوئورید کاهش بار موثر هسته بعلت افزایش تعداد الکترونها را داریم، اما بعلت بار موثر هسته کمتر اتم هیدروژن این کاهش برای هیدروژن بصورت نسبی بیشتر است و از این رو افزایش شعاع از اتم هیدروژن به یون هیدرید در مقایسه با افزایش شعاع از اتم فلوئور به یون فلوئورید بیشتر است و منجر به بزرگتر شدن یون هیدرید (H-) از یون فلوئورید (F-) می شود. بعبارت دیگر بار مؤثر هسته در یون هیدرید بسیار كمتر از یون های نافلزات مثل فلوئورید است و بعلت بار مؤثر هسته ی كم در یون هیدرید و پایین بودن قدرت كنترل هسته بر روی e- ها دافعه ی بین دو الكترون در این یون سبب انبساط ابرالكترونی و افزایش شعاع یونی آن می شود. در یون های نافلزات مثل فلوئورید بعلت واقع شدن اتم های آنها در انتهای دوره ها و افزایش بار مؤثر هسته در طول هر دوره، بار مؤثر هسته در مقایسه با بار مؤثر هسته ی یون هیدرید بیشتر است.
*****
رابطه ی قطری
روند تغییرات اغلب خواص اتمی مثل بار مؤثر هسته، انرژی یونش، شعاع های اتمی و یونی و .... از چپ به راست و از بالا به پایین در جدول تناوبی متضاد هم است. به همین علت برای هر عنصر، عنصر واقع در یك گروه و یك تناوب بعد از لحاظ خواص اتمی شباهت خواهد داشت. این تشابه رابطه ی قطری نامیده می شود. رابطه ی قطری معمولاً برای لیتیم با منیزیم و بریلیم با آلومینیوم در نظر گرفته می شود.
تمرین: در جدول تناوبی شبه فلزات تقریباً بر روی یک قطر قرار دارند. چگونه توجیه می کنید؟
*****
||||||||||||||||||||||||||||||||||||||||||||||||||
**************************************************
سایت: www.youngchemist.com
مولف: محمد شاهی
نظرات، پیشنهادات و انتقادات: chemistry.shahi@gmail.com
**************************************************
||||||||||||||||||||||||||||||||||||||||||||||||||