انرژي يونش
به حداقل مقدار انرژی لازم برای كندن الكترون از یك اتم، مولکول یا یون در حالت گازی شكل انرژی یونش می گویند. بعنوان مثال انرژی یونش A، حداقل مقدار انرژی لازم برای انجام واکنش زیر است:
انرژی یونش معمولا با واحد الکترون ولت بازای هر اتم، مولکول یا یون یا واحد کیلوژول بر مول گزارش می شود.
برای هرگونه بتعداد الکترونهایش می توان انرژی یونش تعریف کرد. انرژی های یونش یک گونه بصورت انرژی یونش اول یا نخستین انرژی یونش (IE1)،انرژی یونش دوم یا دومین انرژی یونش (IE2)،انرژی یونش سوم یا سومین انرژی یونش (IE3) و ... مشخص می شوند که در آنها اولین، دومین، سومین و ... بیانگر مرتبه یونش است و شماره الکترونی که کنده می شود، را نشان می دهد. در هر یونش الكترون با بیشترین سطح انرژی كنده می شود یا بعبارتی اولویت با ناپایدارترین است. بعنوان مثال داریم:
|
|
|
|
|
|
|
. |
. |
|
. |
. |
|
. |
. |
|
|
|
مثال: سیزدهمین انرژی یونش گوگرد (16S) مربوط به کدام واکنش است؟ آرایش الکترونی گونه های دخیل را بنویسید.
حل:
مربوط به واکنش زیر است:
![]()
که
در آن آرایش
الکترونی ![]() و
و
![]() بترتیب
بصورت 1s22s2
و 1s22s1 است.
بترتیب
بصورت 1s22s2
و 1s22s1 است.
*****
تغييرات انرژي يونشهاي متوالي يك عنصر
انرژی های یونش متوالی یك عنصر با افزایش مرتبه یونش، افزایش می یابد. با افزایش مرتبه یونش، جداكردن الكترون به علت افزایش بار مثبت یونی كه الكترون از آن جدا می شود و در نتیجه افزایش جاذبه ها و كاهش دافعه ها، سخت تر می شود و انرژی مورد نیاز افزایش می یابد. در تغییرات انرژی های یونش متوالی یك عنصر دو نوع جهش (افزایش ناگهانی یا شدیدتر در مقایسه با روند افزایشی کلی معمول) مشاهده می شود: جهش های كوچك به خاطر معمولا تغییر زیر لایه ها و بهم خوردن آرایش نیمه پر (که اولی معمولا اهمیت بیشتری دارد) و جهش های بزرگ به خاطر تغییر لایه ها. جهش های كوچك و بزرگ منعكس كننده ی وجود زیرلایه ها و لایه ها هستند.
بعنوان مثال جدول و نمودار انرژی های یونش متوالی عنصر فسفر را که در ادامه آمده است، در نظر بگیرید. آرایش الکترونی فسفر به صورت 1s22s22p63s23p3 و از IE1 تا IE15 بترتیب زیرلایه های 2s,2p,3s,3p و درنهایت 1s الکترون از دست می دهند.
|
1011.8 |
IE1 |
|
1907 |
IE2 |
|
2914.1 |
IE3 |
|
4963.6 |
IE4 |
|
6273.9 |
IE5 |
|
21267 |
IE6 |
|
25431 |
IE7 |
|
29872 |
IE8 |
|
35905 |
IE9 |
|
40950 |
IE10 |
|
46261 |
IE11 |
|
54110 |
IE12 |
|
59024 |
IE13 |
|
271790 |
IE14 |
|
296194 |
IE15 |
جدول انرژیهای یونش متوالی فسفر بر حسب کیلوژول بر مول

نمودار انرژیهای یونش متوالی فسفر بر حسب کیلوژول بر مول
با توجه به اعداد جدول و همچنین از روی نمودار می توان دید که از IE5 به IE6 بعلت تغییر لایه اصلی از n=3 به n=2 و از IE13 به IE14 بعلت تغییر لایه اصلی از n=2 به n=1 جهش بزرگ داریم. از طرفی با توجه به اعداد جدول از IE3 به IE4 بعلت تغییر زیرلایه از 3p به 3s و از IE11 به IE12 بعلت تغییر زیرلایه از 2p به 2s جهش کوچک داریم. همچنین از IE8 به IE9 بعلت بهم خوردن آرایش نیمه پر جهش ریزی مشاهده می شود.
همانطور که مثال انرژیهای یونش متوالی اتم فسفر نیز نمایش می دهد، تشخیص جهش های بزرگ به مراتب ساده تر از تشخیص جهش های کوچک است. در جهشهای بزرگ تغییرات انرژی یونش بسیار قابل توجه است (گاهی اوقات حتی چهار تا پنج برابر می شود)، در حالیکه در حالت عادی (بدون جهش بزرگ حتی با وجود جهش کوچک) IEn بیشتر از IEn-1، اما معمولا کمتر از دو برابر IEn-1 است. از تعداد و محل رخداد جهش های بزرگ می توان برای تشخیص موقعیت عنصر در جدول تناوبی و شناسایی عنصر استفاده کرد. بطور کلی برای عناصر اصلی اگر در كل n جهش بزرگ داشته باشیم، عنصرمتعلق به دوره (n+1) در جدول تناوبی است و اگر اولین جهش بزرگ از IEm به IEm+1 باشد، عنصرمتعلق به گروه mA است.
مثال : در كل انرژی های یونش متوالی یك عنصر ، دو جهش بزرگ مشاهده می شود و اولین جهش بزرگ آن از انرژی یونش دوم به سوم رخ می دهد. این عنصر را با نام و نماد مشخص كرده و آرایش الكترونی آن را بنویسید.
حل:
با توجه به مطالب بحث شده بایستی متعلق به گروه دوم تناوب سوم جدول تناوبی باشد و بنابراین منیزیم است که برای نماد و آرایش الكترونی آن داریم:
*****
مثال: نه انرژی یونش اول سه عنصر از عناصر اصلی به صورت زیر است، شماره گروه هر عنصر را تعیین كنید.
|
|
IE9 |
IE8 |
IE7 |
IE6 |
IE5 |
IE4 |
IE3 |
IE2 |
IE1 |
|
الف) |
25437 |
21997 |
4271 |
3623 |
2633 |
2009 |
1446 |
805 |
401 |
|
ب) |
6913 |
6092 |
4808 |
3969 |
3192 |
2281 |
1651 |
1091 |
118 |
|
ج) |
7614 |
6558 |
5567 |
4391 |
3544 |
2765 |
655 |
434 |
136 |
حل:
الف) گروه هفت اصلی (VIIA)
ب) گروه یک اصلی (IA)
ج) گروه سه اصلی (IIIA)
*****
تغييرات
![]() در
عنصرهاي
مختلف
در
عنصرهاي
مختلف
در نخستین انرژی یونش عناصر یك دوره الكترون از لایه ی یكسانی كنده می شود اما از چپ به راست بعلت افزایش بار مؤثر هسته، جدا كردن الكترون سخت تر می شود و نخستین انرژی یونش افزایش می یابد. نمودار بعدی نخستین انرژی یونش عناصر تناوب دوم را نشان می دهد و می توان بوضوح دید که روند کلی افزایش نخستین انرژی یونش از لیتیم به نئون است.
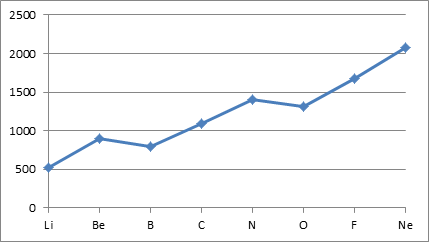
نخستین انرژی یونش عناصر تناوب دوم
همانطور که در نمودار دیده می شود، روند کلی یاد شده (افزایش نخستین انرژی یونش از چپ به راست در یک دوره) از گروه دو اصلی به سه اصلی و از گروه پنج اصلی به شش اصلی در دوره دوم جدول تناوبی صادق نیست. برای توجیه آنها می توان به صورت در ادامه آمده استدلال کرد.
علیرغم اینكه بار مؤثر هسته در بور بیشتر از بریلیم است، نخستین انرژی یونش بریلیم بیشتر از بور است. در بریلیم الكترون اول از 2s كنده می شود، در حالیكه در بور از 2p كنده می شود. زیرلایه 2s از 2p پایدارتر است و افزایش بار موثر هسته از بریلیم به بور هم نمی تواند سطح انرژی زیرلایه 2p بور را کمتر از سطح انرژی زیرلایه 2s بریلیم قرار دهد. پس در بریلیم در مقایسه با بور الکترون اول از زیرلایه پایدارتری کنده می شود و از این رو نخستین انرژی یونش بریلیم بیشتر از بور است. در حالیکه افزایش بار موثر هسته از بریلیم به کربن می تواند سطح انرژی زیرلایه 2p کربن را کمتر از سطح انرژی زیرلایه 2s بریلیم قرار دهد و از این رو نخستین انرژی یونش کربن بیشتر از بریلیم است.
در مورد کاهش نخستین انرژی یونش از اتم نیتروژن به اتم اکسیژن می توان گفت که علیرغم بار مؤثر هسته بیشتر اتم اكسیژن نخستین انرژی یونش اتم نیتروژن به علت پایداری ناشی از آرایش نیمه پر بیشتر است. بعبارت دیگر موقع کندن اولین الکترون از اتم نیتروژن آرایش نیمه پر و پایداری ناشی از آرایش نیمه پر از دست می رود، در حالیکه موقع کندن اولین الکترون از اتم اکسیژن آرایش نیمه پر و پایداری ناشی از آرایش نیمه پر به دست می آید. پس پایداری ناشی از آرایش نیمه پر به نخستین انرژی یونش اتم نیتروژن می افزاید، در حالیکه از نخستین انرژی یونش اتم اکسیژن می کاهد و از این رو نخستین انرژی یونش اتم نیتروژن بیشتر از اتم اکسیژن می شود.
در یك گروه از جدول تناوبی از بالا به پایین تعداد لایه ها افزایش می یابد که معمولا همراه با افزایش فاصله الکترونهای خارجی از هسته نیز است. این افزایش فاصله از هسته از بالا به پایین در یك گروه معمولا مهمتر از افزایش بار مؤثر هسته است. از این رو معمولا جاذبه الكترون های خارجی با هسته از بالا به پایین در یك گروه كم می شود و نخستین انرژی یونش كاهش می یابد. بعنوان مثال نمودار بعدی نخستین انرژی یونش عناصر گروه هفت اصلی (هالوژنها) را نمایش می دهد.
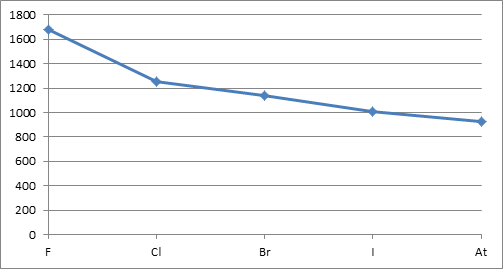
نمودار نخستین انرژی یونش هالوژنها
برای مقایسه انرژی های یونش مرتبه بالاتر عناصر یا انرژی نخستین یونش كاتیون ها با بار دلخواه اما برابر می توان اتم های خنثی هم الكترون با یون هایی که قرار است در آن یونش الکترون از دست بدهند، را بدست آورد و برای این اتم های خنثی مقایسه ی نخستین انرژی های یونش را انجام داد و سپس همین مقایسه را به كاتیون ها با بار دلخواه یا انرژی های یونش مرتبه بالاتر تعمیم داد. مثال در ادامه آمده را در نظر بگیرید.
مثال: انرژی یونش سوم عناصر سدیم(11Na)، منیزیم (12Mg) و آلومینیوم (13Al) را با هم مقایسه کنید.
حل:
در یونش سوم سدیم، منیزیم و آلومینیوم از کاتیونهای Na2+، Mg2+ و Al3+ الکترون می کنیم که به ترتیب با 9F، 10Ne و 11Na هم الکترون هستند. از آنجائیکه ترتیب انرژی یونش اول فلوئور، نئون و سدیم بصورت Ne>F>Na است، ترتیب انرژی یونش اول Na2+، Mg2+ و Al3+ که همان ترتیب انرژی یونش سوم سدیم، منیزیم و آلومینیوم است، بصورت زیر خواهد بود:
![]()
*****
||||||||||||||||||||||||||||||||||||||||||||||||||
**************************************************
سایت: www.youngchemist.com
مولف: محمد شاهی
نظرات، پیشنهادات و انتقادات: chemistry.shahi@gmail.com
**************************************************
||||||||||||||||||||||||||||||||||||||||||||||||||