گرماشيمي
مطالعه
گرما و انرژي
در فرآيندهاي
شيميائي از
جنبه هاي
گوناگوني
حائز اهميت
است. اين امر در
گرماشيمي
صورت مي گيرد.
معمولاً
فرآيند ها در
حجم ثابت يا
در فشار ثابت
مطالعه مي
شوند. از اين
رو مطالعه
گرماي مبادله
شده در فرآيند
ها نيز
معمولاً تحت
اين شرايط
صورت مي گيرد
كه در ادامه
بدان مي
پردازيم. فقط
دقت داشته
باشيد
همانطور كه
قبلاً نيز
گفتيم، در
فرآيند هاي شيميائي
معمولاً فقط
كار تغيير حجم
در نظر گرفته
مي شود و از
كارهاي غير
تغيير حجم (
مثل كار
الكتريكي و...)
صرف نظر مي
شود. در اين
صورت كار همان
کار تغییر حجم
است كه در حجم
ثابت برابر
صفر و در فشار ثابت
برابر![]() است
.
است
.
براي يك فرآيند در حجم ثابت با توجه به صفر بودن كارتغيير حجم مي توانيم بنويسيم :
![]()
بنابراين براي يك فرآيند درحجم ثابت تغييرانرژي دروني سيستم برابر گرماي مبادله شده است. ممكن است ثابت بودن حجم را بصورت يك انديس در نماد كميت ها نمايش دهيم و رابطه قبلي را بصورت زير بنويسيم:
![]()
براي يك فرآيند در فشار ثابت مي توانيم بنويسيم :
![]()
![]()
بنابراين
براي يك
فرآيند در
فشار ثابت
تغيير آنتالپي
سيستم برابر
گرماي مبادله
شده است و علامت
آن دو نيز با
هم يكي است. پس
منفي بودن ![]() به
معناي گرماده
بودن فرآيند و
مثبت بودن
به
معناي گرماده
بودن فرآيند و
مثبت بودن![]() به
معناي گرما
گيربودن
فرآيند است.
با توجه به
مطالب قبلي
ميتوان ديد كه
با اندازه
گيري گرماي
مبادله شده در
يك فرآيند در
حجم ثابت مي
توان تغيير
انرژي دروني
سيستم و در يك
فرآيند در
فشار ثابت مي
توان تغيير
آنتالپي
سيستم را بدست
آورد. براي اندازه
گيري گرما مي
توان از
گرماسنج ها
(كاريمترها)
كمك گرفت. در
گرماسنج هاي
معمول، از
گرماي مبادله
شده در فرآيند
براي تغيير دماي
محتويات گرما
سنج (معمولاً
آب) استفاده
مي شود و از
روي اندازه
گيري تغييرات
دما و ظرفيت
گرمايي
گرماسنج
گرماي مبادله
شده اندازه
گيري مي شود.
براي اندازه
گيري
به
معناي گرما
گيربودن
فرآيند است.
با توجه به
مطالب قبلي
ميتوان ديد كه
با اندازه
گيري گرماي
مبادله شده در
يك فرآيند در
حجم ثابت مي
توان تغيير
انرژي دروني
سيستم و در يك
فرآيند در
فشار ثابت مي
توان تغيير
آنتالپي
سيستم را بدست
آورد. براي اندازه
گيري گرما مي
توان از
گرماسنج ها
(كاريمترها)
كمك گرفت. در
گرماسنج هاي
معمول، از
گرماي مبادله
شده در فرآيند
براي تغيير دماي
محتويات گرما
سنج (معمولاً
آب) استفاده
مي شود و از
روي اندازه
گيري تغييرات
دما و ظرفيت
گرمايي
گرماسنج
گرماي مبادله
شده اندازه
گيري مي شود.
براي اندازه
گيري ![]() از
گرماسنج در
شرايط حجم
ثابت و براي
اندازه گيري
از
گرماسنج در
شرايط حجم
ثابت و براي
اندازه گيري ![]() از
گرماسنج در
شرايط فشار
ثابت استفاده
مي شود.
از
گرماسنج در
شرايط فشار
ثابت استفاده
مي شود.
يك گرماسنج در حجم ثابت مي تواند بصورت يك ظرف صلب قرار گرفته درون مخزني از آب بعنوان محل انجام فرایند باشد كه كل آن توسط جداره هاي عايق حرارتي احاطه شده باشد و يك دماسنج براي اندازه گيري دماي آب مخزن و بعضاً يك همزن براي يكنواخت كردن دماي آب درون مخزن وجود داشته باشد. شكل بعدي را در نظر بگيريد.
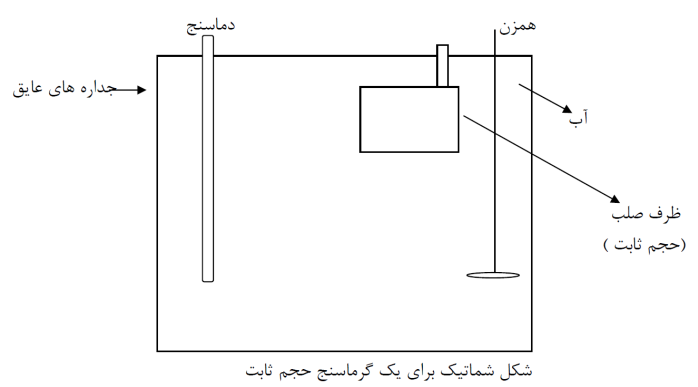
فرآيند
تحت مطالعه در
ظرف صلب انجام
مي شود و از
آنجائيكه حجم
آن ثابت است،
تغيير انرژي
دروني در
فرآيند برابر
گرماي مبادله
شده توسط ظرف
صلب با محيط
اطراف يعني
عمدتاً آب درون
مخزن است. اين
گرما سبب
تغيير دماي آب
و ديگر مواد
موجود در فضاي
درون جداره
هاي عايق (مثل
ديواره هاي
ظرف صلب) مي
شود. با
خواندن دما
قبل از انجام
فرآيند (دماي
اوليه) و بعد
از انجام
فرآيند و
يكنواخت شدن
دماي درون
گرماسنج (دماي
ثانويه) مي
توان تغيير (![]() )
را اندازه
گيري نمود و
بصورت زير
)
را اندازه
گيري نمود و
بصورت زير![]() را
بدست آورد:
را
بدست آورد:
ظرفيت گرمايي ديگر مواد موجود + ظرفيت گرمايي آب درون گرماسنج = ظرفيت گرمايي كل گرماسنج
![]()
![]() گرماي
گرفته شده
توسط گرماسنج
گرماي
گرفته شده
توسط گرماسنج
![]() گرماي
گرفته شده
توسط سيستم
گرماي
گرفته شده
توسط سيستم ![]() تغيير
انرژي دروني
تغيير
انرژي دروني
دقت
داشته باشيد
كه براي يك
فرآيند با ![]() ،
بعلت گرماده
بودن
،
بعلت گرماده
بودن ![]() و
براي يك
فرآيند با
و
براي يك
فرآيند با ![]() ،
بعلت گرما گير
بودن
،
بعلت گرما گير
بودن ![]() خواهد
بود.
خواهد
بود.
مثال:
هنگاميكه ![]() گرم
اتانول مايع (
گرم
اتانول مايع (![]() )
در يك
كالريمتر حجم
ثابت سوزانده
مي شود، دماي
كالريمتر از
)
در يك
كالريمتر حجم
ثابت سوزانده
مي شود، دماي
كالريمتر از ![]() به
به
![]() افزايش
مي يابد. كالريمتر
محتوي
افزايش
مي يابد. كالريمتر
محتوي ![]() كيلو
گرم آب ( ظرفيت
گرمايي ويژه
آب برابر 1
كالري بر گرم
بر درجه سانتي
گراد است) مي
باشد و ظرفيت
گرمايي
دستگاه
(كالريمتر
بدون آب)
كيلو
گرم آب ( ظرفيت
گرمايي ويژه
آب برابر 1
كالري بر گرم
بر درجه سانتي
گراد است) مي
باشد و ظرفيت
گرمايي
دستگاه
(كالريمتر
بدون آب) ![]() است .
است .
الف) گرماي مبادله شده در فرآيند بالا (موقع سوختن اتانول) را بدست آوريد.
ب) گرماي سوختن بازاي يك گرم را براي اتانول مايع تعيين كنيد.
ج) تغيير انرژي دروني موقع سوختن اتانول مايع را بازاي يك گرم و يك مول تعيين كنيد.
حل :
الف)
![]()
![]()
![]()
ب) گرماي
مبادله شده در
بخش (الف)
بازاي ![]() گرم
اتانول بوده،
بنابراين
گرماي سوختن
بازاي يك گرم
اتانول بصورت
زير خواهد
بود:
گرم
اتانول بوده،
بنابراين
گرماي سوختن
بازاي يك گرم
اتانول بصورت
زير خواهد
بود:
![]() گرماي
سوختن بازاي
هر گرم اتانول
گرماي
سوختن بازاي
هر گرم اتانول
ج) از آنجائيكه فرآيند سوختن اتانول در اينجا حجم ثابت است ، تغيير انرژي دروني برابر گرماي مبادله شده با رعايت علامت است. پس داريم:
![]() تغيير
انرژي دروني
بازاي يك گرم
تغيير
انرژي دروني
بازاي يك گرم
![]() تغيير
انرژي دروني
بازاي يك مول
تغيير
انرژي دروني
بازاي يك مول
*****
در صورتيكه فرآيند را در فشار ثابت انجام دهيم، گرماي مبادله شده برابر تغيير آنتالپي خواهد بود. براي انجام يك فرآيند در فشار ثابت مي توان فرآيند را در يك ظرف درباز انجام داد كه در اينصورت بعلت وجود امكان مبادله آسان گرما با محيط اطراف براي گرماسنج مناسب نخواهد بود. براي داشتن گرماسنج در فشار ثابت معمولاً بخشي از ديواره هاي گرماسنج بصورت انعطاف پذير در نظر گرفته مي شود. ديواره هاي انعطاف پذير تحمل اختلاف فشار در دو طرف ديواره را ندارند و بنابراين در طول انجام فرآيند فشار درون ديواره ها با فشار بيرون ديواره ها يا همان فشار جو كه ثابت است، يكي مي ماند. بعنوان مثال براي يك گرماسنج با فشار ثابت بسيار ساده مي توان يك ليوان پلاستيكي با يك درپوش را در نظر گرفت كه مي تواند براي اندازه گيري گرماي حاصل از فرآيند هاي شيميائي كه در محلول درون ليوان رخ مي دهند، استفاده شود. ديواره پلاستيكي از يك طرف عايق حرارتي خوبي است و اجازه مبادله گرما با محيط اطراف را نمي دهد و ازطرف ديگر انعطاف پذير است و شرط ثابت ماندن فشار در طول فرآيند را برقرار مي كند.
مثال: ![]() محلول
محلول
![]() با
با
![]() محلول
محلول
![]() در
يك بشر با هم
مخلوط مي شوند
تا با هم به
صورت زير
واكنش دهند:
در
يك بشر با هم
مخلوط مي شوند
تا با هم به
صورت زير
واكنش دهند:
![]()
دماي
اوليه
محلولها ![]() و
دماي نهايي
محلول حاصل از
اختلاط و
انجام واكنش
و
دماي نهايي
محلول حاصل از
اختلاط و
انجام واكنش ![]() است.
از مبادله
گرما با محيط
اطراف صرف نظر
شود و ظرفيت
گرمايي ويژه و
چگالي محلول
نهايي به
ترتيب برابر
است.
از مبادله
گرما با محيط
اطراف صرف نظر
شود و ظرفيت
گرمايي ويژه و
چگالي محلول
نهايي به
ترتيب برابر ![]() كالري
بر گرم بر
درجه سانتي
گراد و
كالري
بر گرم بر
درجه سانتي
گراد و ![]() گرم بر
سانتي متر
مكعب فرض
شوند. گرماي
مبادله شده،
تغيير
آنتالپي فرآيند
ياد شده و
تغيير
آنتالپي مولی واكنش
ياد شده را
بدست آوريد.
گرم بر
سانتي متر
مكعب فرض
شوند. گرماي
مبادله شده،
تغيير
آنتالپي فرآيند
ياد شده و
تغيير
آنتالپي مولی واكنش
ياد شده را
بدست آوريد.
حل :
با فرض
اينكه اختلاط
بدون تغییر
حجم صورت مي گيرد،
حجم محلول
نهايي از جمع
حجمهاي دو
محلول اختلاط
شونده برابر ![]() بدست
مي آيد و
خواهيم داشت:
بدست
مي آيد و
خواهيم داشت:
![]() حجم
محلول
حجم
محلول ![]() چگالي
محلول
چگالي
محلول ![]() جرم
محلول
جرم
محلول
![]() ظرفيت
گرمايي ويژه
ظرفيت
گرمايي ويژه ![]() جرم
محلول
جرم
محلول ![]() ظرفيت
گرمايي محلول
ظرفيت
گرمايي محلول
![]() تغيير
دما
تغيير
دما ![]() ظرفيت
گرمايي محلول
ظرفيت
گرمايي محلول ![]() گرماي
مبادله شده
گرماي
مبادله شده
از آنجائيكه فرآيند در فشار ثابت رخ مي دهد، مقدار گرماي مبادله شده بيانگر مقدار تغيير آنتالپي فرآيند با رعايت علامت است و داريم:
![]()
در واكنش
ياد شده ![]() با
با ![]() واكنش
مي دهد.
بنابراين ∆H بدست آمده
قبلي بازاي
واكنش
مي دهد.
بنابراين ∆H بدست آمده
قبلي بازاي ![]() از
مواد واكنش
دهنده است.
براي تعيين
تغيير آنتالپي
مولي، تغيير
آنتالپي
واكنش را
بازاي يك مول
از مواد واكنش
دهنده بصورت
زير بدست مي
آوريم:
از
مواد واكنش
دهنده است.
براي تعيين
تغيير آنتالپي
مولي، تغيير
آنتالپي
واكنش را
بازاي يك مول
از مواد واكنش
دهنده بصورت
زير بدست مي
آوريم:
![]() تغيير
آنتالپي مولي
تغيير
آنتالپي مولي
*****
اغلب
اوقات فرآيند
هاي شيميائي
در فشار ثابت (و
نه در حجم
ثابت) رخ مي
دهند.
بنابراين
تعيين گرماي مبادله
شده معمولاً
بر اساس ![]() صورت
مي گيرد و
ازاين رو
استفاده از
صورت
مي گيرد و
ازاين رو
استفاده از ![]() متداولتر
از استفاده از
متداولتر
از استفاده از
![]() است.
است.
درمورد ![]() يا
تغيير هر تابع
حالت ديگر مثل
يا
تغيير هر تابع
حالت ديگر مثل
![]() يك
قانون
پرکاربرد به
نام قانون هِس
يا قانون جمع
بندي ثابت
گرما وجود دارد
كه در ادامه
با آن آشنا مي
شويم.
يك
قانون
پرکاربرد به
نام قانون هِس
يا قانون جمع
بندي ثابت
گرما وجود دارد
كه در ادامه
با آن آشنا مي
شويم.
||||||||||||||||||||||||||||||||||||||||||||||||||
**************************************************
سایت: www.youngchemist.com
مولف: محمد شاهی
نظرات، پیشنهادات و انتقادات: chemistry.shahi@gmail.com
**************************************************
||||||||||||||||||||||||||||||||||||||||||||||||||