استوكيومتري واکنشها
همانطور که قبلا هم گفتیم، استوكيومتري بخش از شيمي است كه با نسبت مقدار عنصرها در تركيبها و نيز ارتباط (ارتباطهاي كمي) بين مقدار مواد شركت كننده در واكنشهاي شيميايي سروکار دارد. براساس معادلهي موازنه شدهي واكنش ميتوان بين تعداد مول يا جرم مواد شركت كننده ارتباط برقرار كرد. بعنوان مثال واکنش موازنه شده زیر را در نظر بگیرید:
![]()
بر اساس
واکنش موازنه شده
بالا دو مول ![]() با
پنج مول
با
پنج مول ![]() واکنش
می دهد و یک
مول
واکنش
می دهد و یک
مول ![]() و
شش مول
و
شش مول ![]() می
دهد که بصورت
زیر هم می
تواند نمایش
داده شود:
می
دهد که بصورت
زیر هم می
تواند نمایش
داده شود:
![]()
![]()
و معادل هم ارزی زیر است:
![]()
که ضرایب تبدیلی مثل ضرایب تبدیل زیر را می تواند نتیجه دهد:
![]()
از طرفی
بر اساس واکنش
موازنه شده
یادشده جرم دو
مول ![]() یعنی
یعنی
![]() با
جرم پنج مول
با
جرم پنج مول ![]() یعنی
یعنی
![]() واکنش
می دهد و جرم
یک مول
واکنش
می دهد و جرم
یک مول ![]() یعنی
یعنی
![]() و
جرم شش مول
و
جرم شش مول ![]() یعنی
یعنی ![]() را
نتیجه می دهد
که بصورت زیر
هم می تواند
نمایش داده
شود:
را
نتیجه می دهد
که بصورت زیر
هم می تواند
نمایش داده
شود:
![]()
که معادل هم ارزی زیر است:
![]()
که ضرایب تبدیلی مثل ضرایب تبدیل زیر را می تواند نتیجه دهد:
![]()
همچنین می توان بین تعداد مول و جرم واکنش دهنده ها هم ارزی هایی در نظر گرفت و ضرایب تبدیلی مثل ضرایب تبدیل زیر بدست آورد:
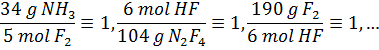
مثال: فسفر
سفيد (![]() )
ميتواند با
اكسيژن هوا (
)
ميتواند با
اكسيژن هوا (![]() )
واكنش دهد و
تركيب
)
واكنش دهد و
تركيب ![]() را
توليد كند. در
يك آزمايش
را
توليد كند. در
يك آزمايش ![]() در
اثر واكنش با
اكسيژن هوا به
طور كامل به
در
اثر واكنش با
اكسيژن هوا به
طور كامل به ![]() تبديل
ميشود.(P=31,O=16)
تبديل
ميشود.(P=31,O=16)
الف) معادلهي موازنه شدهي واكنش را بنويسيد.
ب) به ازاي
هر مول فسفر
سفيد چند مول
و چند گرم اكسيژن
مصرف ميشود؟
چند مول و چند
گرم ![]() توليد
ميشود؟
توليد
ميشود؟
ج) در
آزمايش ياد
شده چندگرم
اكسيژن و چند
گرم ![]() به
ترتيب مصرف و
توليد ميشود؟
به
ترتيب مصرف و
توليد ميشود؟
حل:
الف)![]()
ب)
![]()
![]()
ج)
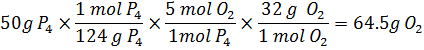
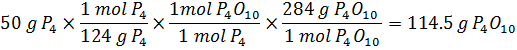
*****
مثال: گاز
شهري عمدتاً
از گاز متان ![]() تشكيل
شده است. به
ازاي هر
كيلوگرم از
گاز شهري چند
ليتر هوا براي
سوختن كامل متان
و تبديل آن به
تشكيل
شده است. به
ازاي هر
كيلوگرم از
گاز شهري چند
ليتر هوا براي
سوختن كامل متان
و تبديل آن به ![]() لازم
است؟ فرض كنيم
هر ليتر هوا
لازم
است؟ فرض كنيم
هر ليتر هوا ![]() دارد.
دارد.
حل:
![]()
![]()
*****
||||||||||||||||||||||||||||||||||||||||||||||||||
**************************************************
سایت: www.youngchemist.com
مولف: محمد شاهی
نظرات، پیشنهادات و انتقادات: chemistry.shahi@gmail.com
**************************************************
||||||||||||||||||||||||||||||||||||||||||||||||||