قطبیت پیوندها و مولکول ها
اتم های عناصر مختلف توانایی های مختلفی برای جذب الکترون به سمت خود دارند. الکترونگاتیویته یک عنصر معیاری از قدرت نسبی آن عنصر در جذب الکترونهای پیوندی به سمت خود است. الکترونگاتیویته را معمولا با علامت χ (حرف خی کوچک یونانی) نشان می دهند. معمولا الکترونگاتیویته عناصر در یک دوره از چپ به راست بعلت افزایش بار موثر هسته و کاهش شعاع و در یک گروه از پایین به بالا بعلت کاهش شعاع افزایش می یابد. در این راستا فلوئور الکترونگاتیوترین عنصر و سزیم عنصر پایدار با کمترین الکترونگاتیویته (الکتروپوزیتیوترین عنصر پایدار) است. عناصر با الکترونگاتیویته بالا رفتار نافلزی دارند و عناصر با الکترونگاتیویته پایین رفتار فلزی از خود نشان می دهند. شبه فلزات عناصری با الکترونگاتیویته متوسط هستند و رفتاری مابین فلزات و نافلزات دارند. در این راستا، یکی از معیارهای طبقه بندی به فلزات، شبه فلزات و نافلزات الکترونگاتیویته هیدروژن است. نافلزات عناصری هستند که الکترونگاتیویته آنها بیشتر از الکترونگاتیویته هیدروژن است. فلزات عناصری هستند که الکترونگاتیویته آنها کمتر از الکترونگاتیویته هیدروژن است و شبه فلزات عناصری هستند که الکترونگاتیویته شان در حدود الکترونگاتیویته هیدروژن است.
در صورت وجود اختلاف الکترونگاتیویته در اتمهای تشکیل دهنده پیوند کووالانسی ابر الکترونی به سمت اتم با الکترونگاتیویته بالاتر متمایل می شود و روی اتم با الکترونگاتیویته بالاتر فزونی ابر الکترونی و روی اتم با الکترونگاتیویته پایین تر کمبود ابر الکترونی بوجود می آید. بنابراین وجود اختلاف الکترونگاتیویته در اتمهای تشکیل دهنده پیوند کووالانسی منجر به ایجاد بارهای جزیی بر روی اتم های تشکیل دهنده پیوند می شود و پیوند سر مثبت و سر منفی یا خصلت یونی پیدا می کند. این را میتوان با رزونانس یونی ـ کووالانسی زیر برای پیوند AB که اتم B الکترونگاتیوتر از اتم A است، نمایش داد:
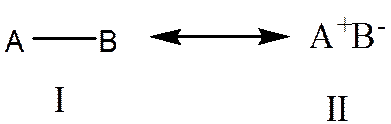
شکل رزونانسی I برای پیوند AB، 100% خصلت کووالانسی در نظر می گیرد و در این شکل جفت الکترون پیوندی به سمت هیچ یک از دو اتم منحرف نشده است. شکل رزونانسیII برای پیوند AB، 100% خصلت یونی در نظر می گیرد و در این شکل جفت الکترون پیوندی بر روی فقط اتم B قرار دارد. در حالت کلی هیبرید رزونانسی بصورت زیر خواهد بود:
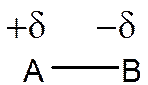
که δ
بیانگر اندزه
بار جزیی روی
اتمهاست. درصد
سهم شکل
رزونانسی II که
معادل نسبت
بار واقعی روی
اتمها به بار
فرضی روی
اتمها بر
مبنای انتقال
کامل الکترون
است (برای
مثال قبلی
نسبت δ به e که δ بار
واقعی روی
اتمها و e بار یک
الکترون است)،
خصلت یونی
پیوند نامیده
می شود. در
مقابل خصلت
یونی پیوند،
خصلت
کووالانسی پیوند
قرار دارد که درصد
سهم شکل
رزونانسی I است.
مجموع
درصدهای خصلت
یونی پیوند و
خصلت
کووالانسی
پیوند بایستی
برابر 100% باشد. با
افزایش اختلاف
الکترونگاتیویته
بین دو اتم
تشکیل دهنده
پیوند، مقدار بارهای
جزیی بر روی
اتم های
تشکیل دهنده
پیوند و خصلت
یونی پیوند
افزایش می یابند.
خصلت یونی
پیوند می تواند
از صفر در
مولکولهایی
مانند ![]() و
و
![]() تا
نزدیک 100% در نمکهایی
مثل سزیم
فلوئورید
تغییر کند. معمولا
پیوندهای با
خصلت یونی
کمتر از 50%
کووالانسی و
پیوندهای با
خصلت یونی
بیشتر از 50%
یونی محسوب می
شوند.
تا
نزدیک 100% در نمکهایی
مثل سزیم
فلوئورید
تغییر کند. معمولا
پیوندهای با
خصلت یونی
کمتر از 50%
کووالانسی و
پیوندهای با
خصلت یونی
بیشتر از 50%
یونی محسوب می
شوند.
وجود
بارهای جزئی
به علت جاذبه
بین بارهای
جزئی مثبت و
منفی باعث
پایداری پیوند
می شود. هر چه
اختلاف
الکترونگاتیویته
دو اتم تشکیل دهنده
پیوند بیشتر
باشد، بارهای
جزئی حاصل
بزرگتر و
پیوند پایدارتر
می شود. این
مطلب خودش را
در مقایسه
انرژی
پیوندهای A-A ,B-B
,A-B نشان
می دهد. پیوند A-B (مثلا H-F) از نظر
اتمهای تشکیل
دهنده بین
پیوندهای A-A و B-B
(مثلا H-H,F-F)
قرار دارد،
بنابراین
انتظار داریم
انرژی پیوند A-B نیز مابین
یا حتی وسط
(برابر
میانگین)
انرژی پیوندهای
A-A و B-B
باشد. با وجود
اینکه معمولا
انرژی پیوند A-B مابین
انرژی
پیوندهای A-A و B-B
قرار دارد (یعنی
معمولا داریم:![]() )،
اما معمولا
انرژی پیوند A-B که جاذبه
بین بارهای
جزئی مثبت و
منفی اش دارد،
از میانگین (حسابی
یا هندسی)
انرژی
پیوندهای A-A و B-B
که بارهای
جزئی مثبت و
منفی و جاذبه
بین آنها را
ندارند بیشتر
است. یعنی معمولا
داریم:
)،
اما معمولا
انرژی پیوند A-B که جاذبه
بین بارهای
جزئی مثبت و
منفی اش دارد،
از میانگین (حسابی
یا هندسی)
انرژی
پیوندهای A-A و B-B
که بارهای
جزئی مثبت و
منفی و جاذبه
بین آنها را
ندارند بیشتر
است. یعنی معمولا
داریم:
![]()
بعنوان مثال انرژی پیوندهای H-H,H-Cl,Cl-Cl به ترتیب برابر 432,427,243 کیلو ژول بر مول هستند. بعنوان مثالی دیگر انرژی پیوندهای Cl-Cl, C-Cl, C-C به ترتیب برابر 243,339,347 کیلو ژول بر مول هستند.
این نکته معیار نسبت دادن مقدار به الکترونگاتیویته عناصر در مقیاس پائولینگ است. در این مقیاس اختلاف الکترونگاتیویته بین دو اتم متناسب با جذر اختلاف انرژی پیوند A-B با میانگین هندسی انرژی پیوندهای A-A و B-B در نظر گرفته می شود. یعنی در روش پاولینگ برای اختلاف الکترونگاتیویته بین دو اتم داریم:
![]()
که در رابطه بالا مقادیر انرژی پیوندها بر حسب کیلوکالری بر مول هستند و مقدار ثابت تناسب برابر 0.208 است.
بر اساس رابطه بالا اختلاف الکترونگاتیویته عناصر به دست می آید. با نسبت دادن 4 به الکترونگاتیویته فلوئور و با استفاده از اختلاف الکترونگاتیویته های به دست آمده الکترونگاتیویته تمام عناصر به دست می آید. مثلا مقدار الکترونگاتیویته چند نافلز متداول در مقیاس پاولینگ بصورت زیر است:
![]()
مقدار الکترونگاتیویته عناصر مختلف در شکل بعدی آمده است. دقت داشته باشید برای گازهای نجیب در مقیاس پاولینگ، از آنجاییکه گازهای نجیب معمولا ترکیب تشکیل نمی دهند، الکترونگاتیویته درنظر گرفته نمی شود.
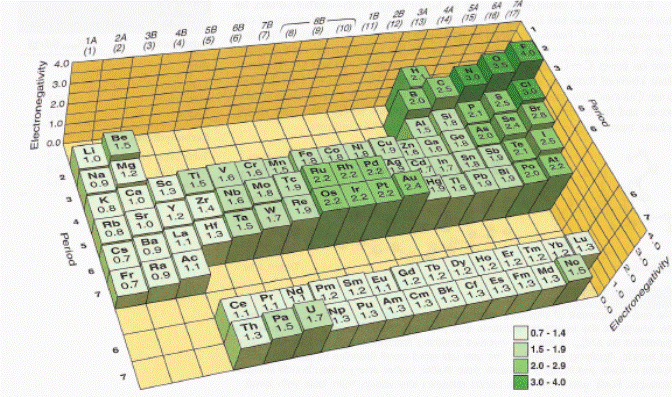
نمایش الکترونگاتیویته عناصر در مقیاس پاولینگ که از کتاب شیمی ماهیت مولکولی ماده و تغییر نوشته سیلبربرگ گرفته شده است. الکترونگاتیویته عناصر با ارتفاع موقعیت آنها در جدول تناوبی نمایش داده شده است و همچنین کنار نماد عنصر نوشته شده است. موقعیت اتم هیدروژن نزدیک عناصر با الکترونگاتیویته مشابه انتخاب شده است.
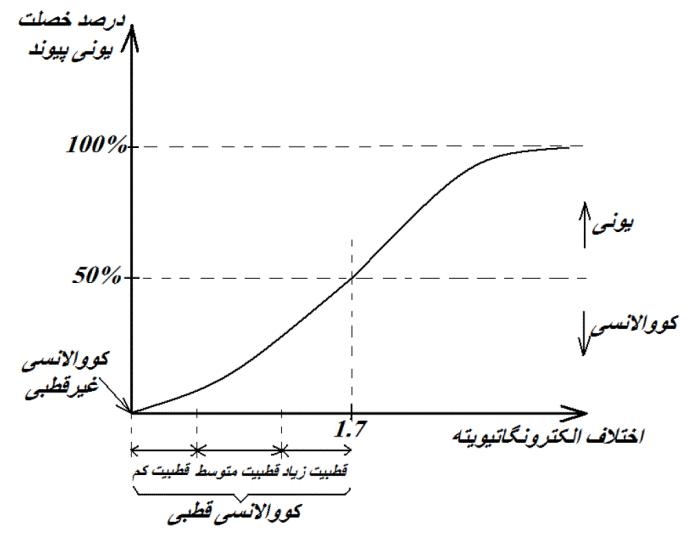
بعنوان یک قاعده سرانگشتی، در صورتیکه اختلاف الکترونگاتیویته اتمهای تشکیل دهنده پیوند در مقیاس پاولینگ از 1.7 بیشتر باشد، خصلت یونی پیوند بیشتر از 50% خواهد بود و پیوند یونی می تواند محسوب شود. در صورتیکه اختلاف الکترونگاتیویته اتمهای تشکیل دهنده پیوند در مقیاس پاولینگ از 1.7 کمتر باشد، خصلت یونی پیوند کمتر از 50% خواهد بود و پیوند کووالانسی می تواند محسوب شود.
برای پیوندهای کووالانسی، قطبیت پیوند در نظر می شود که بصورت کمی با کمیتی به نام گشتاور دو قطبی پیوند توصیف می شود که در ادامه با آن آشنا خواهیم شد. قطبیت پیوند معمولا با خصلت یونی پیوند رابطه مستقیم دارد. بعبارتی با افزایش اختلاف الکترونگاتیویته بین دو اتم تشکیل دهنده پیوند و خصلت یونی پیوند، قطبیت پیوند افزایش می یابد. پیوندهای کووالانسی با خصلت یونی صفر، کووالانسی غیرقطبی و پیوندهای کووالانسی با خصلت یونی غیرصفر، کووالانسی قطبی نامیده می شوند. بعنوان یک قاعده سرانگشتی، پیوندهای کووالانسی که خصلت یونیشان کمتر از 10% است، پیوندهای کووالانسی با قطبیت کم، پیوندهای کووالانسی که خصلت یونیشان از 10% تا 30% است، پیوندهای کووالانسی با قطبیت متوسط و پیوندهای کووالانسی که خصلت یونیشان از 30% تا 50% است، پیوندهای کووالانسی با قطبیت زیاد می توانند محسوب شوند. بعنوان یک قاعده سرانگشتی اختلاف الکترونگاتیویته بین 0 و 0.5 در مقیاس پائولینگ معادل قطبیت کم، اختلاف الکترونگاتیویته بین 0.5 و 1 معادل قطبیت متوسط و اختلاف الکترونگاتیویته بین 1 و 1.7 معادل قطبیت زیاد برای پیوند کووالانسی می توانند محسوب شوند. مطالب یادشده در نمودار خصلت یونی پیوند بر حسب اختلاف الکترونگاتیویته زیر نمایش داده شده اند:
پیوندهای قطبی بعلت داشتن بارهای جزئی مثبت و منفی می توانند با ذرات باردار دیگر برهمکنش های الکتریکی داشته باشند. بزرگی و قدرت این برهمکنش ها متناسب با کمیتی به نام گشتاور دوقطبی است که به دو بار الکتریکی هم اندازه و ناهمنام واقع در کنار یکدیگر نسبت داده می شود. برای دو بار الکتریکی هم اندازه و ناهمنام واقع در کنار یکدیگر که یک دوقطبی الکتریکی نامیده می شود، گشتاور دوقطبی برداری است که راستای آن روی خط واصل دو ذره باردار و جهت آن از بار منفی به بار مثبت است. اندازه آن هم از حاصلضرب اندازه بارها و فاصله بین دو بار بدست می آید. در مورد پیوندها، گشتاور دوقطبی پیوند که معمولا با μ (از حروف کوچک الفبای یونانی به نام مو) نشان داده می شود، برداری است که راستای آن روی خط واصل دو اتم تشکیل دهنده پیوند و جهت آن از سر منفی پیوند به سر مثبت پیوند است (البته گاهی اوقات، موقع نمایش گشتاور دوقطبی پیوند، جهت آن از سر مثبت پیوند به سر منفی پیوند درنظر گرفته می شود که دراینصورت بر جهت کشیده شدن الکترونها تاکید شده است). اندازه آن نیز از رابطه زیر بهدست میآید:
![]() فاصله
بارها
فاصله
بارها ![]() اندازه
بار جزئی =
اندازه
گشتاور دو
قطبی
اندازه
بار جزئی =
اندازه
گشتاور دو
قطبی
که در رابطه بالا δ بیانگر اندازه بارهای جزیی روی اتمها و r بیانگر فاصله اتمها یا همان طول پیوند است. مقدار گشتاور دوقطبی پیوند یا μ برای پیوندهای غیرقطبی برابر صفر و برای پیوندهای قطبی مخالف صفر است. برای پیوندهای قطبی بزرگی μ بیانگر مقدار قطبیت پیوند است. با افزایش μ پیوند قطبیتر محسوب می شود. هر دو عامل مقدار بارهای جزئی و طول پیوند در بزرگی μ موثرند، اما معمولاً عامل مقدار بارهای جزئی یا اختلاف الکترونگاتیویته دو اتم تشکیل دهنده پیوند در بزرگی μ مهمتر است.
واحد گشتاور دوقطبی در SI کولن متر (C.m) است. برای بیان گشتاور دوقطبی پیوندها و مولکولها از واحد کوچکتر دبای (که با D نشان داده می شود) استفاده می شود که 1 D برابر 3.34×10-30C.m است. بعنوان مثال گشتاور دوقطبی پیوندهای HF,HCl,HBr,HI به ترتیب برابر 1.83,1.11,0.83,0.45 دبای هستند.
تمرین: گشتاور دو قطبی پیوندهای ClF,BrF,IF در زیر ذکر شده است. کدام گشتاور دو قطبی مربوط به کدام پیوند است؟ چرا؟
1.95D, 0.89D,1.42D
*****
تمرین: گشتاور دو قطبی پیوند HF برابر 1.83D و طول پیوند HF برابر 92pm است. بر این مبنا بار جزیی روی اتمهای H و F را در پیوند HF حساب کنید و درصد خصلت یونی پیوند HF را بدست آورید. پیوند HF را بایستی یونی در نظر گرفت یا کووالانسی؟
*****
برای مولکولها نیز گشتاور دوقطبی می توان در نظر گرفت. گشتاور دوقطبی یک مولکول با جمع برداری گشتاور دوقطبی تمامی پیوندهای آن و گاهی اوقات جفت های غیرپیوندی به دست می آید. اگر گشتاور دوقطبی مولکول برابر صفر باشد، مولکول غیرقطبی و اگر گشتاور دوقطبی مولکول غیرصفر باشد، مولکول قطبی است. مثالهای در ادامه آمده را در نظر بگیرید.
در مولکول BeF2 دو پیوند BeF یکسان با زاویه 180° و گشتاور دوقطبی پیوند برابر داریم که جمع برداری دو بردار هم اندازه با زاویه 180° نسبت بهم صفر می شود. بنابراین گشتاور دوقطبی مولکول برابر صفر است و مولکول BeF2 یک مولکول غیر قطبی است.
همانطور که مثال قبلی نشان می دهد یک مولکول ممکن است پیوندهای قطبی داشته باشد، اما غیرقطبی باشد. در مولکول BF3 سه پیوند BF یکسان با زاویه 120° و گشتاور دوقطبی پیوند برابر داریم که جمع برداری سه بردار هم اندازه با زاویه 120° نسبت بهم صفر می شود. بنابراین گشتاور دوقطبی مولکول برابر صفر است و مولکول BF3 یک مولکول غیرقطبی است.
در مولکول H2O دو پیوند OH یکسان با زاویه 104.5° و گشتاور دوقطبی پیوند برابر داریم که جمع برداری دو بردار هم اندازه با زاویه 104.5° نسبت بهم صفر نمی شود. بنابراین گشتاور دوقطبی مولکول برابر غیر صفر است و مولکول H2O یک مولکول قطبی است. گشتاور دوقطبی این مولکول از آزمایش های تجربی برابر 1.85D بدست می آید. با توجه به الکتونگاتیویته بیشتر اکسیژن در مقایسه با هیدروژن، سر منفی این مولکول بر روی اتم اکسیژن و سر مثبت آن در وسط دو اتم هیدروژن قرار دارد.
تمرین: مولکول CF4 غیر قطبی است. چگونه توجیه می کنید؟
*****
تمرین: گشتاور دو قطبی مولکول های AsF3,AsCl3,AsH3 در زیر ذکر شده است. کدام گشتاور دو قطبی مربوط به کدام مولکول است؟ چرا؟
0.217D, 1.59D, 2.59D
*****
جفت های غیرپیوندی روی اتمها را می توان دو قطبی الکتریکی در نظر گرفت که هسته اتم سر مثبت آن و جفت غیرپیوندی سر منفی آن است. بنابراین می توان برای جفت های غیرپیوندی نیز گشتاور دوقطبی در نظر گرفت. گاهی اوقات در تعیین گشتاور دوقطبی یک مولکول بایستی در جمع برداری، گشتاور دوقطبی مربوط به جفت های غیرپیوندی را در کنار گشتاور دوقطبی تمامی پیوندها درنظر گرفت. مثال بعدی از این نکته استفاده می کند.
مثال: با وجود آنکه اختلاف الکترونگاتیویته فلوئور و نیتروژن (1) با اختلاف الکترونگاتیویته نیتروژن و هیدروژن (0.9) تقریبا برابر است، گشتاور دوقطبی NF3 (=0.235Dμ) خیلی کمتر از NH3 (=1.47Dμ) است. این پدیده را چگونه توجیه می کنید؟
حل:
گشتاور دوقطبی پیوندها و جفت الکترون غیرپیوندی در NH3 همدیگر را تقویت می کنند، درحالیکه در NF3 همدیگر را تضعیف می کنند. به همین علت قطبیت NF3 خیلی کمتر از NH3 است.
*****
||||||||||||||||||||||||||||||||||||||||||||||||||
**************************************************
سایت: www.youngchemist.com
مولف: محمد شاهی
نظرات، پیشنهادات و انتقادات: chemistry.shahi@gmail.com
**************************************************
||||||||||||||||||||||||||||||||||||||||||||||||||