مواردی که از قاعده اکتت تبعیت نمی کنند
به طور کلی سه دسته از ترکیبات از قاعده اکتت تبعیت نمیکنند:
1) ترکیباتی
که کمبود
الکترون
دارند، مانند:
![]() و . . .
و . . .
2) ترکیباتی
که تعداد
الکترونهای
والانس آنها
عددی فرد است،
مانند: ![]() و
. . .
و
. . .
3) ترکیباتی
که از لایه
والانس گسترش
یافته استفاده
می کنند،
مانند: ![]() .
. .
.
. .
در ادامه به بررسی این سه دسته می پردازیم.
ترکیبات دسته اول
این
ترکیبات اتمهایی
مثل ![]() ،
،
![]() ،
،
![]() و
. . . دارند که
موقع تشکیل
ترکیب ممکن
است تعداد الکترونهایشان
کمتر از 8 باشد.
بعنوان مثال
داریم:
و
. . . دارند که
موقع تشکیل
ترکیب ممکن
است تعداد الکترونهایشان
کمتر از 8 باشد.
بعنوان مثال
داریم:
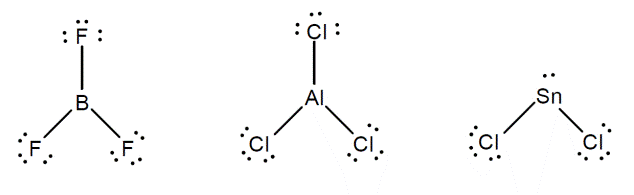
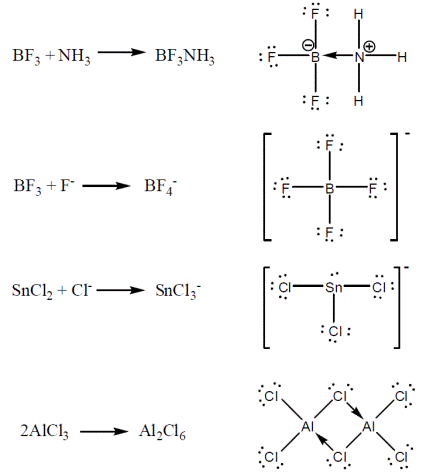
این ترکیبها از قاعده اکتت تبعیت نمی کنند و واکنش هایی می دهند تا ترکیباتی تشکیل دهند که از قاعده اکتت تبعیت می کنند. مثالهای در ادامه آمده را در نظر بگیرید. در مثالهای یاد شده به ساختار محصولات که از اکتت تبعیت می کنند، توجه کنید.
لازم بذکر است که مر به معنی واحد سازنده است. در صورتیکه واحد سازنده ما A باشد و بتواند با ترکیب شدن با یکدیگر A2،A3،A4،A5 و ... را بوجود آورد، A2،A3،A4،A5 و ... به ترتیب دیمر، تریمر، تترامر، پنتامر و ... A محسوب می شوند و A مونومر آنها محسوب می شود. بعنوان مثال Al2Cl6 دیمر AlCl3 و AlCl3 مونومر Al2Cl6 محسوب می شود. در صورتیکه تعداد زیادی A با هم ترکیب شوند و An را بوجود آورند که n عدد بزرگی است، An پلیمر A محسوب می شود. پیشوند پلی به معنی خیلی یا زیاد است. ساختار پلیمرها با نمایش تکه دلخواهی از پلیمر یا نمایش واحد تکرار شونده نشان داده می شود. بعنوان مثال ترکیب BeCl2 در حالت جامد برای رسیدن بور به هشتایی به صورت مولکولهای پلیمری زنجیری شکل در می آید که با ساختارهای زیر نمایش داده می شود:
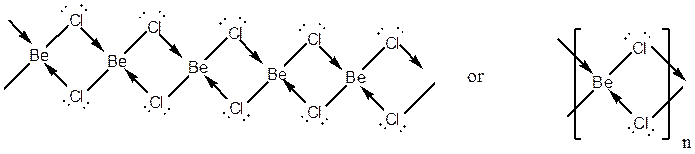
ترکیبات دسته دوم
ترکیباتی
که مجموع
الکترونهای
والانس آنها
عددی فرد می باشد،
در ساختار لوییسشان
نهایتاً یک
الکترون به
صورت جفت نشده
باقی خواهد
ماند. به چنین
ترکیباتی
«رادیکال» یا
«رادیکال
آزاد» گفته می شود.
رادیکالها
عموماً
ترکیباتی فوق العاده
ناپایدارند و
تنها به عنوان
حد واسط در
برخی واکنشهای
شیمیایی
مشاهده می شوند.
از رادیکالهای
نسبتاً
پایدار می
توان به ![]() و
و
![]() اشاره کرد. ساختار
برخی از
رادیکالها را
در ادامه می
بینیم:
اشاره کرد. ساختار
برخی از
رادیکالها را
در ادامه می
بینیم:
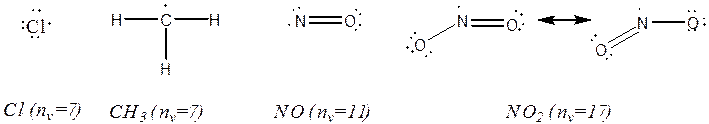
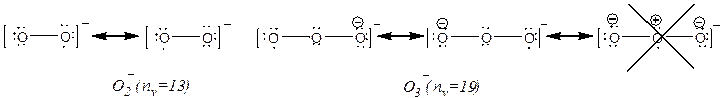
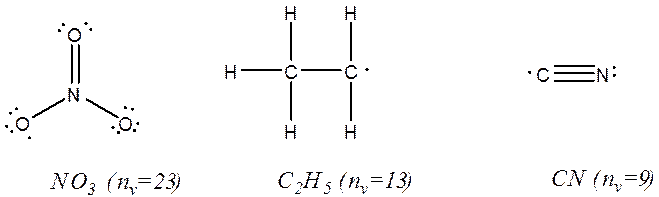
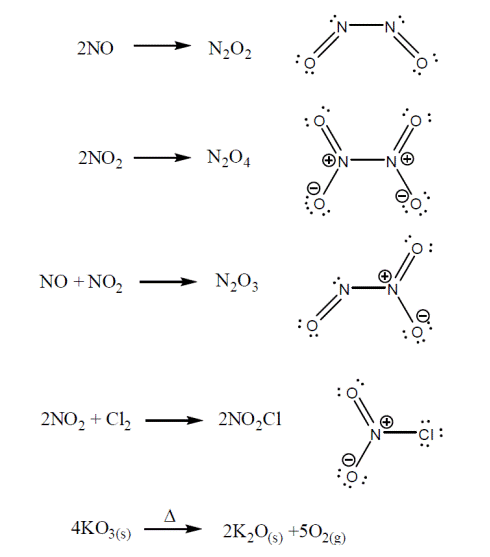
این ترکیبات نیز واکنش هایی می دهند تا ترکیباتی تشکیل دهند که نهایتاً از قاعده اکتت تبعیت کنند. بعنوان مثال داریم:
تمرین: چه تعداد از ترکیبات زیر رادیکال هستند؟
![]()
*****
ترکیبات دسته سوم
عناصر
تناوب سوم و
به بعد که
اوربیتال ![]() دارند میتوانند
لایه والانس
خود را گسترش
دهند و از این
اوربیتالها
نیز در تشکیل
پیوند
استفاده کنند.
در صورت گسترش
لایه والانس
تعداد
الکترونهای
حول اتم بیشتر
از 8 میشود و
ترکیب از اکتت
تبعیت نمی کند.
برخلاف
ترکیبات دسته
اول و دوم،
ترکیبات دسته
سوم هم
فراوانند و هم
عموماً
پایدارند. بعنوان
مثال، ساخت
تخیلی
مولکولهای PF3 و PF5 را می توان در
نظر گرفت. اتم
فسفر در حالت
عادی سه
اوربیتال
حاوی تک الکترون
دارد و
درصورتیکه از
هر اوربیتال
حاوی تک الکترون
برای
همپوشانی با
اوربیتال
حاوی تک الکترون
یک اتم فلوئور
استفاده کند،
مولکول فسفر
تری فلوئورید
را بوجود می آورد.
مولکول فسفر
تری فلوئورید از
قاعده اکتت
پیروی میکند و
از
دارند میتوانند
لایه والانس
خود را گسترش
دهند و از این
اوربیتالها
نیز در تشکیل
پیوند
استفاده کنند.
در صورت گسترش
لایه والانس
تعداد
الکترونهای
حول اتم بیشتر
از 8 میشود و
ترکیب از اکتت
تبعیت نمی کند.
برخلاف
ترکیبات دسته
اول و دوم،
ترکیبات دسته
سوم هم
فراوانند و هم
عموماً
پایدارند. بعنوان
مثال، ساخت
تخیلی
مولکولهای PF3 و PF5 را می توان در
نظر گرفت. اتم
فسفر در حالت
عادی سه
اوربیتال
حاوی تک الکترون
دارد و
درصورتیکه از
هر اوربیتال
حاوی تک الکترون
برای
همپوشانی با
اوربیتال
حاوی تک الکترون
یک اتم فلوئور
استفاده کند،
مولکول فسفر
تری فلوئورید
را بوجود می آورد.
مولکول فسفر
تری فلوئورید از
قاعده اکتت
پیروی میکند و
از ![]() در ساخت این
مولکول استفاده
نشده است. از
طرفی با صرف
انرژی می توان
یک الکترون 3s اتم
فسفر را به
اوربیتال 3d
برد و پنج
اوربیتال
حاوی تک
الکترون بدست
آورد و
درصورتیکه
اتم فسفر از
هر اوربیتال
حاوی تک
الکترون برای
همپوشانی با
اوربیتال
حاوی تک
الکترون یک
اتم فلوئور
استفاده کند،
مولکول فسفر
پنتا فلوئورید
را بوجود می
آورد. مولکول
فسفر پنتا فلوئورید
از قاعده اکتت
پیروی نمی کند
و از
در ساخت این
مولکول استفاده
نشده است. از
طرفی با صرف
انرژی می توان
یک الکترون 3s اتم
فسفر را به
اوربیتال 3d
برد و پنج
اوربیتال
حاوی تک
الکترون بدست
آورد و
درصورتیکه
اتم فسفر از
هر اوربیتال
حاوی تک
الکترون برای
همپوشانی با
اوربیتال
حاوی تک
الکترون یک
اتم فلوئور
استفاده کند،
مولکول فسفر
پنتا فلوئورید
را بوجود می
آورد. مولکول
فسفر پنتا فلوئورید
از قاعده اکتت
پیروی نمی کند
و از ![]() در ساخت این
مولکول
استفاده شده
است. داریم:
در ساخت این
مولکول
استفاده شده
است. داریم:
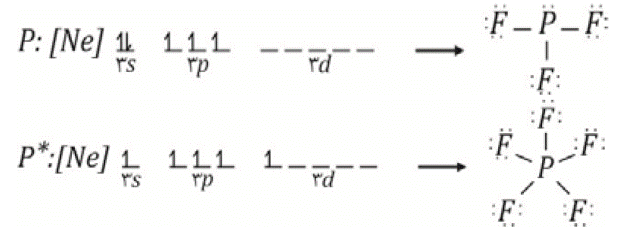
دقت داشته باشید که عناصر تناوب دوم اوربیتال d ندارند و نمی توانند لایه والانس خود را گسترش دهند، بنابراین دور اتمهای عناصر تناوب دوم بیش از هشت الکترون امکان پذیر نیست. بهمین جهت است که مثلا هم PF3 و هم PF5 داریم، در حالیکه NF3 داریم اما NF5 نداریم؛ یا مثلا هم SF2 ، هم SF4 و هم SF6 داریم، درحالیکه OF2 داریم اما OF4 و OF6 نداریم.
مفهوم ظرفیت در تعیین فرمول و ساختار این ترکیبات و همچنین ترکیبات قبلی که آشنا شدیم، می تواند مفید واقع شد. ظرفیت یک عنصر تعداد اتمهای هیدروژنی است که با یک اتم آن عنصر ترکیب می شود یا تعداد اتمهای هیدروژنی است که بوسیله یک اتم آن عنصر می تواند در ترکیبات جابه جا یا جایگزین شود. مثلا با توجه به اینکه نیتروژن با هیدروژن ترکیب NH3 را بوجود می آورد یا می توان سه اتم هیدروژن در ترکیب CH4 را با یک اتم نیتروژن جایگزین کرد و ترکیب HCN را بدست آورد، ظرفیت نیتروژن برابر سه فرض می شود. بر مبنای تعریف ظرفیت می توان نتیجه گرفت که یک اتم یک عنصر تک ظرفیتی با یک اتم یک عنصر تک ظرفیتی دیگر واکنش می دهد یا یک اتم یک عنصر سه ظرفیتی با سه اتم یک عنصر تک ظرفیتی دیگر واکنش می دهد و ... . در حالت کلی اتمهای عناصر مختلف به شکلی با هم واکنش می دهند و در کنار یکدیگر قرار می گیرند که ظرفیت آنها رعایت شده باشد. مثلا اتمهای عناصر A و B با ظرفیت های به ترتیب برابر n و m با همدیگر ترکیب AmBn را بوجود می آورند.
در صورتیکه اتم نافلز در ترکیب با عناصر دیگر از قاعده اکتت بدون گرفتن بار قراردادی تبعیت کند، ظرفیت برابر هشت منهای شماره گروه خواهد بود. در صورتیکه اتم نافلز در ترکیب با عناصر دیگر از قاعده اکتت همراه با گرفتن بار قراردادی تبعیت کند، ظرفیت برابر هشت منهای شماره گروه بعلاوه بار قراردادی خواهد بود. بعنوان مثال اتم نیتروژن با بار قرادادی صفر با سه اتم هیدروژن، با بار قرادادی مثبت یک با چهار اتم هیدروژن و با بار قرادادی منفی یک با دو اتم هیدروژن ترکیب می شود و ترکیبات NH3 ، NH4+ و NH2- را بوجود می آورد. در صورت وجود امکان تخطی از قاعده اکتت و با فرض غیر رادیکال بودن ترکیبات یک عنصر، ظرفیت های مختلف آن عنصر می تواند با اضافه کردن مضارب حسابی عدد دو به هشت منهای شماره گروه بعلاوه بار قراردادی اتم عنصر بدست آید به شرطی که ظرفیت از شماره گروه منهای بارقراردادی بیشتر نشود. بعنوان مثال گوگرد با بار قراردادی صفر ظرفیت های 2، 4 و 6 دارد و با فلوئور تک ظرفیتی ترکیبات SF2، SF4 و SF6 را بوجود می آورد. بعنوان مثال دیگر گوگرد با بارقراردادی مثبت یک ظرفیت های 3 و 5 دارد و با فلوئور تک ظرفیتی ترکیبات SF3+ و SF5+ را بوجود می آورد. با توجه به تعریف ظرفیت می توان ادعا نمود که یک عنصر به اندازه ظرفیتش الکترونهای پیوندی از طرف سایر عناصر قبول خواهد کرد. بنابراین مجموع تعداد پیوندهای کووالانسی برابر ظرفیت بکار رفته توسط عنصر در ترکیب خواهد بود. بعنوان مثال اکسیژن با بار قراردادی صفر در ترکیبات دو پیوند دوگانه یا یک پیوند دوگانه تشکیل می دهد و اکسیژن با بار قراردادی منفی یک در ترکیبات یک پیوند یگانه تشکیل می دهد.
مطالب قبلی در مورد ظرفیت در رسم ساختار اغلب ترکیبات می تواند مفید واقع شود. فرض کنید مثلا علاقه مندیم ساختار لوویس PCl4+ را رسم نماییم. می دانیم اتم کلر با بار قراردادی صفر ظرفیت برابر یک و اتم فسفر با بار قراردادی مثبت یک ظرفیت برابر چهار دارد، بنابراین بار مثبت یک ترکیب را به اتم فسفر می دهیم و سپس یک اتم فسفر چهارظرفیتی را با چهار اتم کلر تک ظرفیتی ترکیب می کنیم و ساختار زیر را بدست می آوریم:
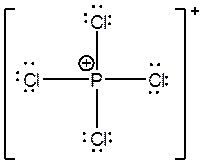
در نهایت
ذکر این نکته
مفید خواهد
بود که ترکیباتی
که تعداد
اتمها و مجموع
تعداد
الکترونهای
لایه
والانسشان
یکسان است،
معمولا ساختارهای
یکسان یا
مشابهی دارند.
مثلا تمام
ترکیبات ![]() پنج
اتم و
پنج
اتم و ![]() دارند
و ساختارهای
آنها به صورت
زیر هستند:
دارند
و ساختارهای
آنها به صورت
زیر هستند:
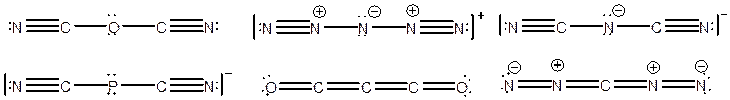
||||||||||||||||||||||||||||||||||||||||||||||||||
**************************************************
سایت: www.youngchemist.com
مولف: محمد شاهی
نظرات، پیشنهادات و انتقادات: chemistry.shahi@gmail.com
**************************************************
||||||||||||||||||||||||||||||||||||||||||||||||||