جدول
تناوبی
فرم
استاندارد یا
معمول جدول
تناوبی های
امروزی بصورت
شبکه ای از
عناصر است که
در هفت سطر و
هیجده ستون
بعلاوه دو سطر
در زیر آنها
قرار گرفته
اند. در جدول
تناوبی سطرها
معمولا دوره یا
تناوب و
ستونها گروه
نامیده می
شوند. دوره ها
با شماره دوره
از یک تا هفت و
گروهها با
شماره گروه از
یک تا هیجده
مشخص می شوند. در
هر دوره از
جدول تناوبی زیرلایه
های  (در
صورت وجود) بترتیب
پر می شوند.
بعبارتی
زیرلایه هایی
که در هر دوره
از جدول
تناوبی پر می
شوند بهمراه
ترتیب پر شدن
آنها بصورت
زیر است:
(در
صورت وجود) بترتیب
پر می شوند.
بعبارتی
زیرلایه هایی
که در هر دوره
از جدول
تناوبی پر می
شوند بهمراه
ترتیب پر شدن
آنها بصورت
زیر است:


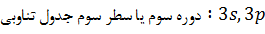




با
توجه به ظرفیت
زیر لایه ها
محل پرشدن زیر
لایه های d,p,s و f
بترتیب شامل 10,6,2 و 14
عنصر خواهد
بود. از
آنجائیکه محل
پرشدن زیرلایه
f شامل 14
عنصر خواهد
بود و نمایش
آن در محل
واقعی منجر به
بسیار طویل
شدن جدول
تناوبی و
ایجاد مشکل در
نمایش آن می
شود، محل
پرشدن
زیرلایه f در پایین
دیگر زیرلایه
ها بصورت
مستقل نمایش داده
می شود. شکل
بعدی این
مطالب را نشان
می دهد.

همانطور
که گفتیم، فرم
استاندارد یا
معمول جدول
تناوبی های
امروزی بصورت
شبکه ای از
عناصر است که
در هفت سطر و
هیجده ستون
بعلاوه دو سطر
در زیر آنها
قرار گرفته
اند که شکل
بعدی، این
مطلب را نمایش
می دهد.
جدول
تناوبی به
چهار بلوک d,p,s و f
می تواند
تقسیم شود که
در هر بلوک،
زیرلایه مربوطه
در حال پر شدن
است. شکل بعدی
را در نظربگیرید.

در
جدول تناوبی،
به عناصری که
اوربیتالهای s و p
آنها در حال
پرشدن است (یا
در واقع در
بلوک s
یا p
قرار دارند) عناصر
گروه اصلی یا
بطور ساده تر عناصر
اصلی، به عناصری
که
اوربیتالهای dآنها در
حال پرشدن است
(یا در واقع در
بلوک d
قرار دارند) فلزات
واسطه خارجی یا
بطور ساده تر فلزات
واسطه و به
عناصری که
اوربیتالهای f آنها در
حال پرشدن است
(یا در واقع در
بلوک f
قرار دارند) فلزات
واسطه داخلی
گفته می شود. به
فلزات واسطه داخلی
که اوربیتالهای
4f آنها در
حال پر شدن
است،
لانتانیدها و
به فلزات
واسطه داخلی
که اوربیتالهای
5f آنها در
حال پر شدن
است،
آکتینیدها می
گویند. شکل
بعدی را در
نظر بگیرید.

همانطور
که گفتیم،
گروهها با
شماره گروه از
یک تا هیجده
مشخص می شوند.
در قدیم که امروزه
نیز استفاده
می شود،
گروههای
عناصر اصلی با
IA تا VIIIA
( معادل 1، 2 و 13
تا 18) و
گروههای
عناصر واسطه
با IB
تا VIIIB
(معادل 3 تا 12)
مشخص می شدند.
شماره گذاری
گروههای
عناصر واسطه
بر اساس شباهت
آنها با
گروههای
عناصر اصلی از
لحاظ ظرفیت
بوده است.
همچنین
هر گروه
معمولا به نام
عنصر بالایی
یا همان
سردسته گروه
که عنصر گروه
با کمترین عدد
اتمی است،
خوانده می
شود. مثلا
گروه آهن را
می توان در
نظر گرفت که
شامل آهن،
روتنیم،
اسمیم و هاسیم
است. برخی
گروهها نیز
نامهای مخصوص
خودشان را
دارند که در
جدول زیر
بهمراه علت
نامگذاری ذکر
شده است.
|
شماره
گروه
|
نام
اختصاصی
|
دلیل
نامگذاری
|
|
گروه 1
یا IA
|
گروه
فلزات
قلیایی
( Alkali Metals)
|
بوجود
آوردن قلیا
(باز) موقع
واکنش فلزات
گروه با آب
|
|
گروه 2
یا IIA
|
گروه
فلزات
قلیایی خاکی
( Alkaline Earth Metals)
|
بوجود
آوردن قلیا
(باز) موقع
واکنش اکسید
فلزات گروه
با آب که
اکسید فلزات
گروه زمانی
در طبقه بندی
خاکیها یا
زمینی ها (
ترکیبات
غیرفلز
نامحلول در
آب و مقاوم در
برابر حرارت)
قرار می
گرفتند.
|
|
گروه 5
یا VA
|
گروه
نیکتوژنها
( Pnictogens)
|
ویژگی
سرفه
آورندگی یا
خفه کنندگی
نیتروژن در
غیاب اکسیژن
|
|
گروه 6
یا VIA
|
گروه
کالکوژنها
( Chalcogens)
|
حضور در
ترکیبات
اغلب سنگ های
معدنی
|
|
گروه 7
یا VIIA
|
گروه
هالوژنها
( Halogens)
|
بوجود
آوردن نمکها
مثل نمک دریا
|
|
گروه 8
یا VIIIA
|
گروه
گازهای نجیب
یا بی اثر
( Noble or Inert Gases)
|
عدم
واکنش پذیری
یا واکنش پذیری
خیلی کم
|
عناصر
واقع در
گروههای
یکسان معمولا
در آرایش
الکترونی بعد
از گاز نجیب
ماقبل خود
مشابهند.
بعنوان مثال
آرایش
الکترونی برای
عناصر گروه
تیتانیم یعنی 72Hf,40Zr,22Ti و 104Rf به ترتیب
بصورت [Xe]6s24f145d2,[Kr]5s24d2,[Ar]4s23d2 و [Rn]7s25f146d2 است که همگی
به (n-1)d2ns2 ( بعلاوه (n-2)f14
در صورت وجود)
ختم می شوند. البته
گاهی اوقات
نیز آرایش
الکترونی
عناصر همگروه
بطور جزئی با
هم متفاوت
است. بعنوان
مثال آرایش
الکترونی برای
عناصر گروه
نیکل یعنی 46Pd,28Ni و 78Pt به
ترتیب بصورت  و
و  است.
عناصر واقع در
گروههای اصلی
یکسان حتما در
آرایش
الکترونی
لایه اصلی آخر
که لایه والانس
نیز نامیده می
شود، یکسانند.
جدول بعدی این
مطلب را نشان
می دهد.
است.
عناصر واقع در
گروههای اصلی
یکسان حتما در
آرایش
الکترونی
لایه اصلی آخر
که لایه والانس
نیز نامیده می
شود، یکسانند.
جدول بعدی این
مطلب را نشان
می دهد.
|
آرایش
الكترونی
لایه آخر
|
گروه
|
|

|
(فلزات
قلیایی)IA (1)
|
|

|
(فلزات
قلیایی خاكی)IIA (2)
|
|

|
(گروه
بور)IIIA
(13)
|
|

|
(گروه
كربن)IVA
(14)
|
|

|
(گروه
نیتروژن)VA (15)
|
|

|
(گروه
اكسیژن)VIA (16)
|
|

|
(گروه
هالوژن ها)VIIA (17)
|
|

|
(گروه
گازهای نجیب)VIIIA (18)
|
عناصر
واقع در گروههای
یکسان معمولا
خواص شیمیایی
کمابیش یکسانی
نشان می دهند،
البته با
افزایش فاصله آنها
در یک گروه
ممکن است
تغییرات قابل
توجهی از بابت
خواص وجود
داشته باشد.
گاهی اوقات
عناصر واقع در
دوره های
یکسان نیز
خواص مشابهی
دارند، مثلا
لانتانیدها
در دوره ششم و
آکتینیدها در
دوره هفتم یا
به مقدار کمتر
فلزات واسطه
خارجی همدوره
را می توان در
نظر گرفت.
همچنین ممکن
است برای برخی
عناصر که در
یک یا چند ویژگی
بخصوص
مشترکند،
دسته بندی های
مخصوصی در نظر
گرفته شود.
بعنوان مثال
می توان فلزات
گرانبها (Precious Metals) را در نظر
گرفت که در
طبیعت
کمیابند ،
گرانبها
هستند و شامل
طلا، نقره،
پلاتین،
پالادیم،
روتنیم، رودیم،
اسمیم و
ایریدیم می
شوند.
عناصر
را می توان به
فلزات (Metals)،
نافلزات (Nonmetals) و شبه
فلزات (Metalloids) طبقه بندی
کرد. بطور
معمول اتمهای
فلزات براحتی
الکترون از دست
می دهند و
کاتیون بوجود
می آورند، در
حالیکه
اتمهای
نافلزات
براحتی
الکترون می
گیرند و آنیون
بوجود می
آورند. شبه
فلزات هم از
نظر خواص
مابین فلزات و
نافلزات
هستند. بعدها
با خواص
فلزات،
نافلزات و شبه
فلزات بیشتر و
دقیقتر آشنا
خواهیم شد. در
حدود 91 عنصر از 118
عنصر جدول
تناوبی فلز
هستند. شکل
بعدی موقعیت
فلزات،
نافلزات و شبه
فلزات را در
جدول تناوبی
نشان می دهد
که فلزات با
رنگ طوسی،
نافلزات با
رنگ آبی و شبه
فلزات با رنگ
زرشکی نمایش
داده شده اند.
در جدول بعدی
عناصری که
خواص شیمیائیشان
بطور دقیق
معلوم نیست،
بدون رنگ
هستند.
|
2He
|
|
1H
|
|
10Ne
|
9F
|
8O
|
7N
|
6C
|
5B
|
|
4Be
|
3Li
|
|
18Ar
|
17Cl
|
16S
|
15P
|
14Si
|
13Al
|
12Mg
|
11Na
|
|
36Kr
|
35Br
|
34Se
|
33As
|
32Ge
|
31Ga
|
30Zn
|
29Cu
|
28Ni
|
27Co
|
26Fe
|
25Mn
|
24Cr
|
23V
|
22Ti
|
21Sc
|
20Ca
|
19K
|
|
54Xe
|
53I
|
52Te
|
51Sb
|
50Sn
|
49In
|
48Cd
|
47Ag
|
46Pd
|
45Rh
|
44Ru
|
43Tc
|
42Mo
|
41Nb
|
40Zr
|
39Y
|
38Sr
|
37Rb
|
|
86Rn
|
85At
|
84Po
|
83Bi
|
82Pb
|
81Tl
|
80Hg
|
79Au
|
78Pt
|
77Ir
|
76Os
|
75Re
|
74W
|
73Ta
|
72Hf
|
57La
|
56Ba
|
55Cs
|
|
118Uuo
|
117Uus
|
116Lv
|
115Uup
|
114Fl
|
113Uut
|
112Cn
|
111Rg
|
110Ds
|
109Mt
|
108Hs
|
107Bh
|
106Sg
|
105Db
|
104Rf
|
89Ac
|
88Ra
|
87Fr
|
|
|
|
|
|
71Lu
|
70Yb
|
69Tm
|
68Er
|
67Ho
|
66Dy
|
65Tb
|
64Gd
|
63Eu
|
62Sm
|
61Pm
|
60Nd
|
59Pr
|
58Ce
|
|
|
|
|
|
103Lr
|
102No
|
101Md
|
100Fm
|
99Es
|
98Cf
|
97Bk
|
96Cm
|
95Am
|
94Pu
|
93Np
|
92U
|
91Pa
|
90Th
|
|
|
خوب
است که عناصر
گروه های اصلی
را بصورت گروه
به گروه
بعلاوه سطر
اول عناصر
واسطه بخاطر
بسپاریم. این
امر در حل
سوالهای
مربوط به جدول
تناوبی می تواند
مفید واقع
شود. بخاطر
سپردن گازهای
نجیب به همراه
اعداد
اتمیشان نیز
می تواند در
بدست آوردن
آرایش
الکترونی
عناصر مفید
باشد. مثالهای
بعدی را در
نظر بگیرید.
مثال:
آرایش
الکترونی سرب
(82Pb) را در حالت
پایه بنویسید.
حل:
عدد
اتمی سرب بین
اعداد اتمی
گازهای نجیب
زنون (54Xe)
و رادون (86Rn)
است. بنابراین
آرایش
الکترونی سرب
به صورت ترکیب
آرایش
الکترونی
زنون با 54
الکترون و
آرایش
الکترونی 82-54=28
الکترون
باقیمانده
خواهد بود. از
آنجائیکه زنون
گاز نجیب دوره
پنجم است، 28
الکترون
باقیمانده در
زیرلایه های
مربوط به تناوب
بعدی یعنی
تناوب ششم که
عبارتنداز 5d,4f,6s و 6p
به ترتیب قرار
خواهند گرفت و
در نهایت
آرایش الکترونی
سرب به صورت
زیر خواهد
بود:
82Pb:[54Xe]4f145d106s26p2
*****
مثال: در
سطر چهارم
جدول تناوبي
آرايش
الكتروني چند
عنصر به 4s1 ختم ميشود؟
حل:
3 تا:
پتاسیم، کروم
و مس.
*****
مثال: آرايش
الكتروني اتم
تلوريم (52Te) را در حالت
پايه بنويسيد.
حل:
52Te: [36Kr] 4d10 5s2
5p4
*****
||||||||||||||||||||||||||||||||||||||||||||||||||
**************************************************
سایت:
www.youngchemist.com
مولف: محمد
شاهی
نظرات،
پیشنهادات و
انتقادات: chemistry.shahi@gmail.com
**************************************************
||||||||||||||||||||||||||||||||||||||||||||||||||
![]() (در
صورت وجود) بترتیب
پر می شوند.
بعبارتی
زیرلایه هایی
که در هر دوره
از جدول
تناوبی پر می
شوند بهمراه
ترتیب پر شدن
آنها بصورت
زیر است:
(در
صورت وجود) بترتیب
پر می شوند.
بعبارتی
زیرلایه هایی
که در هر دوره
از جدول
تناوبی پر می
شوند بهمراه
ترتیب پر شدن
آنها بصورت
زیر است: ![]()
![]()
![]()


