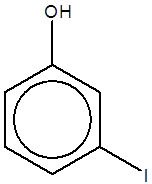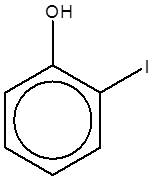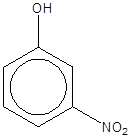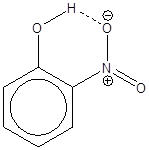فنولها
فنولها
یا فنولیک ها
ترکیباتی هستند
که در آنها
گروه ![]() مستقیما
به یک ترکیب
آروماتیک
متصل است.
فنولها در
واقع بصورت
مستقیما
به یک ترکیب
آروماتیک
متصل است.
فنولها در
واقع بصورت ![]() هستند
که منظور از
هستند
که منظور از ![]() یک
گروه آریل (آروماتیک)
است. فنولها
با اینکه شبیه
الکلها (
یک
گروه آریل (آروماتیک)
است. فنولها
با اینکه شبیه
الکلها (![]() که
که
![]() یک
گروه
آلیفاتیک است)
هستند، اما
خواص متفاوتی
دارند و در
دسته مخصوص
خودشان بررسی
می شوند.
یک
گروه
آلیفاتیک است)
هستند، اما
خواص متفاوتی
دارند و در
دسته مخصوص
خودشان بررسی
می شوند.
ساده ترین
فنل که نام
دسته نیز
براساس نام آن
انتخاب شده
است، ماده
فنول (![]() )
است که همان
حلقه بنزن است
که یکی از
اتمهای هیدروژن
آن با گروه
هیدروکسی
)
است که همان
حلقه بنزن است
که یکی از
اتمهای هیدروژن
آن با گروه
هیدروکسی ![]() جانشین
شده است.
جانشین
شده است.
ایزومری فنلها
ایزومری ساختاری در فنلها با فرض ثابت ماندن بخش آروماتیک، با تغییر نوع و محل اتصال شاخه ها بدست می آید.
مثال:
ایزومرهای
ساختاری ممکن
برای فنولها با
فرمول ![]() را
رسم کنید.
را
رسم کنید.
حل:
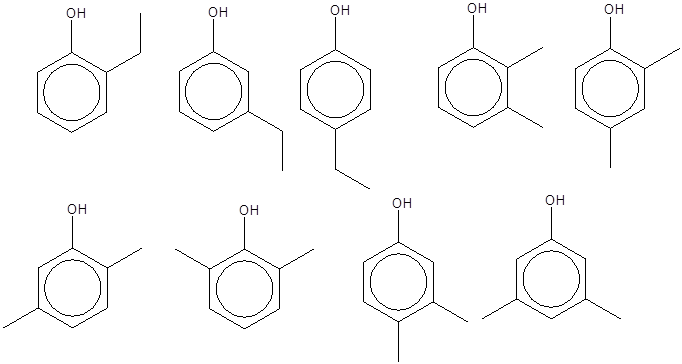
*****
نامگذاری فنلها
در نامگذاری آیوپاک، فنلها براساس نام ترکیب بدون شاخه (به استثنای شاخه هیدروکسی) نامگذاری می شوند. بعنوان مثال نام کلیه فنلهایی که با جانشینی اتمهای هیدروژن ماده فنل با گروههای دیگر مثل گروههای آلکیل یا اتمهای هالوژن بدست می آیند، به فنل ختم می شود.
مثال:
ایزومرهای
ساختاری ممکن
برای فنولها
با فرمول ![]() را
رسم و
نامگذاری
کنید.
را
رسم و
نامگذاری
کنید.
حل:
|
|
|
|
|
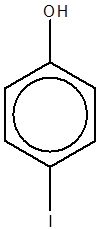
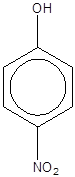
پارایدوفنل |
متایدوفنل |
اورتویدوفنل |
*****
خواص فیزیکی فنلها
از نظر
خواص فیزیکی،
فنلها تا
حدودی شبیه
الکلها هستند.
آنها نیز قطبی
هستند و می توانند
با هم و با
مولکول های
دیگر مثل آب
پیوند
هیدروژنی
تشکیل دهند. البته
گاهی اوقات
ممکن است
پیوند
هیدروژنی بجای
بین مولکولی،
بصورت درون
مولکولی
تشکیل شود که
در اینصورت
دمای ذوب و
جوش کمتر
خواهد بود. بعنوان
مثال در
اورتونیتروفنول
گروههای ![]() و
نیترو (
و
نیترو (![]() )
در مجاورت هم
قرار دارند و
بصورت درون
مولکولی با هم
پیوند
هیدروژنی می دهند،
درحالیکه در
متا و پارا
نیتروفنول
بعلت دوری
گروههای
هیدروکسی و
نیترو از هم
امکان تشکیل
پیوند
هیدروژنی
بصورت درون مولکولی
وجود ندارد و
پیوند
هیدروژنی در
آنها بصورت
بین مولکولی تشکیل
می شود. از این
رو است که
دمای ذوب و
جوش متا و پارا
نیترو فنول از
ایزومرشان
یعنی اورتو
نیترو فنول
بیشتر است.
شکل بعدی را
در نظر
بگیرید:
)
در مجاورت هم
قرار دارند و
بصورت درون
مولکولی با هم
پیوند
هیدروژنی می دهند،
درحالیکه در
متا و پارا
نیتروفنول
بعلت دوری
گروههای
هیدروکسی و
نیترو از هم
امکان تشکیل
پیوند
هیدروژنی
بصورت درون مولکولی
وجود ندارد و
پیوند
هیدروژنی در
آنها بصورت
بین مولکولی تشکیل
می شود. از این
رو است که
دمای ذوب و
جوش متا و پارا
نیترو فنول از
ایزومرشان
یعنی اورتو
نیترو فنول
بیشتر است.
شکل بعدی را
در نظر
بگیرید:
|
|
|
|
|
پارانیتروفنل |
متانیتروفنل |
اورتونیتروفنل |
خواص شیمیایی فنلها
فنلها از
نظر قدرت
اسیدی بین
الکلها و
اسیدهای
کربوکسیلیک
قرار دارند و
در آب اسیدهای
ضعیف محسوب می
شوند. آنها با
بازهای قوی
مثل ![]() واکنش
اسید- باز
انجام می دهند،
درحالیکه با بازهای
ضعیفتر مثل
واکنش
اسید- باز
انجام می دهند،
درحالیکه با بازهای
ضعیفتر مثل ![]() واکنش
نمی دهند.
تفاوت قدرت
اسیدی
اسیدهای
کربوکسیلیک (
واکنش
نمی دهند.
تفاوت قدرت
اسیدی
اسیدهای
کربوکسیلیک (![]() )،
فنلها (
)،
فنلها (![]() )
و الکلها (
)
و الکلها (![]() )
را می توان در
واکنشهای
آنها بصورت
زیر با باز
قوی
)
را می توان در
واکنشهای
آنها بصورت
زیر با باز
قوی ![]() و باز
ضعیف
و باز
ضعیف ![]() مشاهده
نمود:
مشاهده
نمود:
![]()
![]()
![]()
![]()
![]()
![]()
همانطورکه
واکنشهای
بالا نیز نشان
می دهند،
اسیدهای
کربوکسیلیک
هم با باز قوی ![]() و
هم با باز
ضعیف
و
هم با باز
ضعیف ![]() واکنش
می دهند.
فنولها با باز
قوی
واکنش
می دهند.
فنولها با باز
قوی ![]() واکنش
می دهند، اما
بعلت قدرت
اسیدی کمتر در
مقایسه با
اسیدهای
کربوکسیلیک
با باز ضعیف
واکنش
می دهند، اما
بعلت قدرت
اسیدی کمتر در
مقایسه با
اسیدهای
کربوکسیلیک
با باز ضعیف ![]() واکنش
نمی دهند.
الکلها که در
آب فاقد خصلت
اسیدی محسوب می
شوند، نه با
باز قوی
واکنش
نمی دهند.
الکلها که در
آب فاقد خصلت
اسیدی محسوب می
شوند، نه با
باز قوی ![]() و
نه با باز
ضعیف
و
نه با باز
ضعیف ![]() واکنش
نمی دهند.
واکنش
نمی دهند.
لازم به
ذکر است که ![]() ها که از
تفکیک اسیدی
فنولها نتیجه
می شوند،
فنولاتها
نامیده می شوند.
ها که از
تفکیک اسیدی
فنولها نتیجه
می شوند،
فنولاتها
نامیده می شوند.
تفاوت
قدرت اسیدی ![]() و
و ![]() و
و
![]() از
تفاوت
پایداری
آنیونهای
حاصل از تفکیک
اسیدی آنها
یعنی
از
تفاوت
پایداری
آنیونهای
حاصل از تفکیک
اسیدی آنها
یعنی ![]()
![]() ,
, ![]() ,
نتیجه می شود.
تفاوت
پایداری این
آنیونها به
تفاوت پایداری
حاصل از
رزونانس در
آنها بر می گردد.
مطابق شکل زیر
برای یون
کربوکسیلات (
,
نتیجه می شود.
تفاوت
پایداری این
آنیونها به
تفاوت پایداری
حاصل از
رزونانس در
آنها بر می گردد.
مطابق شکل زیر
برای یون
کربوکسیلات (![]() )
دو شکل
رزونانسی خوب
می توانیم در
نظر بگیریم.
برای یون
فنولات رزونانس
داریم، اما
بعلت قرار
گرفتن بار
منفی برروی
اتمهای الکتروپوزیتیو
کربن و از بین
رفتن پایداری
آروماتیک،
رزونانس
فنولاتها
ضعیفتر از کربوکسیلات
هاست و
پایداری
کمتری برای
آنها نتیجه می
دهد.
آلکوکسیدها (
)
دو شکل
رزونانسی خوب
می توانیم در
نظر بگیریم.
برای یون
فنولات رزونانس
داریم، اما
بعلت قرار
گرفتن بار
منفی برروی
اتمهای الکتروپوزیتیو
کربن و از بین
رفتن پایداری
آروماتیک،
رزونانس
فنولاتها
ضعیفتر از کربوکسیلات
هاست و
پایداری
کمتری برای
آنها نتیجه می
دهد.
آلکوکسیدها (![]() )
رزونانس ندارند.
با توجه به
اینکه برای
ماده ای که
محصول حاصل از
تفکیک اسیدی
(جدا شدن
)
رزونانس ندارند.
با توجه به
اینکه برای
ماده ای که
محصول حاصل از
تفکیک اسیدی
(جدا شدن ![]() )
پایدارتر
است، قدرت
اسیدی هم
بیشتر خواهد
بود، ترتیب
قدرت اسیدی
یاد شده توجیه
می شود.
)
پایدارتر
است، قدرت
اسیدی هم
بیشتر خواهد
بود، ترتیب
قدرت اسیدی
یاد شده توجیه
می شود.
:رزونانس در کربوکسیلاتها
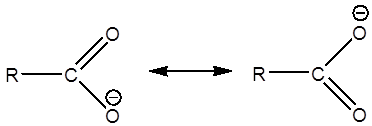
:رزونانس در فنولاتها (خود فنولات بعنوان مثال)

فنلها واکنشهای مهم دیگری نیز دارند که بررسی آنها از حوصله این بحث خارج است.
||||||||||||||||||||||||||||||||||||||||||||||||||
**************************************************
سایت: www.youngchemist.com
مولف: محمد شاهی
نظرات، پیشنهادات و انتقادات: chemistry.shahi@gmail.com
**************************************************
||||||||||||||||||||||||||||||||||||||||||||||||||